Annual Report on Spontaneous Reporting of Adverse Drug Reactions for 2020 - Croatian Document
- 1. Uvod
- 2. Prijave sumnji na nuspojave u 2020. godini
- 2.1. Izvori prijava i načini prijavljivanja
- 2.1.1. Izvori prijava
- 2.1.2. Načini prijavljivanja
- 2.2. Karakteristike prijava sumnji na nuspojave
- 2.2.1. Klasifikacija lijekova
- 2.2.2. Dob i spol bolesnika
- 2.2.3. Broj lijekova u istodobnoj primjeni
- 2.2.4. Ozbiljnost nuspojave
- 2.2.5. Tip nuspojava
- 2.2.6. Ishod nuspojava
- 2.2.7. Nuspojave prema organskim sustavima
- 2.2.8. Najčešće prijavljene nuspojave u 2020. godini
- 2.3. Karakteristike posebnih skupina prijava
- 2.3.1. Prijave sumnji na nuspojave cjepiva
- 2.3.2. Prijave zaprimljene od Centra za kontrolu otrovanja Instituta za medicinska istraživanja i medicinu rada
- 3. Pregled sigurnosnih pitanja u 2020. godini
- 3.1. Pregled najvažnijih sigurnosnih regulatornih mjera poduzetih u 2020. godini
- 3.1.1. Započela nova ocjena lijekova s djelatnom tvari ulipristalacetat zbog rizika od oštećenja jetre i preporučeno ograničenje primjene lijekova s djelatnom tvari ulipristalacetat
- 3.1.2. Preporučeno ograničenje primjene lijekova koji sadrže ciproteron zbog rizika od razvoja meningeoma
- 3.1.3. Započela ocjena određenih lijekova za liječenje karcinoma koji sadrže djelatnu tvar ifosfamid te je zaključeno da koristi primjene nadmašuju rizike
- 3.1.4. Donesene preporuke za testiranje i liječenje lijekovima s djelatnim tvarima fluorouracil, kapecitabin, tegafur i flucitozin zbog nedostatka enzima DPD i povećanog rizika od teške toksičnosti
- 3.1.5. Ograničenje indikacije, dodatne kontraindikacije i mjere minimizacije rizika za lijek Lemtrada (alemtuzumab)
- 3.1.6. Izmjena formulacije lijeka Solu-Medrol 40 mg prašak i otapalo za otopinu za injekciju/infuziju (metilprednizolon) s laktozom u formulaciju bez laktoze
- 3.1.7. Važna sigurnosna izmjena i nove preporuke za prevenciju oštećenja jetre uzrokovanog lijekom Esbriet (pirfenidon)
- 3.1.8. Rizik od oštećenja jetre uzrokovanog lijekovima koji sadrže metamizol
- 3.1.9. Izmjena formulacije lijeka Euthyrox
- 3.2. Pregled ostalih pitanja vezanih uz sigurnost primjene lijekova u 2020. godini
- 3.2.1. HALMED, HZJZ i HFD proveli su kampanju o važnosti cijepljenja u sklopu Europskog i Svjetskog tjedna cijepljenja
- 3.2.2. HALMED u suradnji s HFD-om proveo kampanju o važnosti prijavljivanja sumnji na nuspojave lijekova
- 3.3. Informacije vezane uz bolest COVID-19
- 3.3.1. Odobren prvi lijek za liječenje bolesti COVID-19
- 3.3.2. Pozitivna ocjena primjene deksametazona u liječenju pojedinih bolesnika oboljelih od bolesti COVID-19
- 3.3.3. EMA započela postupnu ocjenu četiriju cjepiva protiv bolesti COVID-19 i odobreno prvo cjepivo protiv bolesti COVID-19
1. Uvod
Na temelju Zakona o lijekovima (Narodne novine, br. 76/13., 90/14. i 100/18.) i pripadajućeg Pravilnika o farmakovigilanciji (Narodne novine, br. 83/13.) Agencija za lijekove i medicinske proizvode (HALMED) prati nuspojave zabilježene u Republici Hrvatskoj koje su zdravstveni radnici i nositelji odobrenja za stavljanje lijeka u promet obvezni prijavljivati. HALMED također zaprima izravne prijave sumnji na nuspojave lijekova od pacijenata/korisnika lijeka, članova obitelji pacijenta/korisnika lijeka ili zakonskih zastupnika/skrbnika (u daljnjem tekstu: pacijent/korisnik lijeka). HALMED prati nuspojave lijekova iz prometa i nuspojave zabilježene u kliničkim ispitivanjima.
Ovo je šesnaesto (16.) izvješće o prijavama sumnji na nuspojave zaprimljenima iz Republike Hrvatske koje je izradio HALMED.
Ukupan broj prijava sumnji na nuspojave u 2020. godini u Republici Hrvatskoj, koje će biti prikazane u ovom Izvješću, čini zbroj sljedećih prijava:
- spontane prijave sumnji na nuspojave lijekova zaprimljene u HALMED-u, koje uključuju:
-
- prijave sumnji na nuspojave koje su HALMED-u izravno uputili zdravstveni radnici
- prijave sumnji na nuspojave koje su HALMED-u izravno uputili pacijenti/korisnici lijeka
- prijave sumnji na nuspojave koje su nositelji odobrenja za stavljanje lijeka u promet zaprimili od zdravstvenih radnika i pacijenata/korisnika lijeka te ih proslijedili HALMED-u
- prijave iz objavljenih literaturnih podataka o nuspojavama koje HALMED-u prosljeđuju nositelji odobrenja za stavljanje lijeka u promet ili Europska agencija za lijekove (EMA) putem svoje usluge za praćenje medicinske literature za određene lijekove (MLM - Medical Literature Monitoring servis)
- spontane prijave sumnji na nuspojave cjepiva zaprimljene u HALMED-u, koje uključuju:
-
- prijave sumnji na nuspojave cjepiva koje su HALMED-u izravno uputili zdravstveni radnici i pacijenti/korisnici cjepiva
- prijave sumnji na nuspojave cjepiva koje su nositelji odobrenja za stavljanje lijeka u promet zaprimili od zdravstvenih radnika i pacijenata/korisnika lijeka te ih proslijedili HALMED-u
- prijave sumnji na nuspojave cjepiva koje je zaprimio Hrvatski zavod za javno zdravstvo (HZJZ) te ih proslijedio HALMED-u
- prijave sumnji na nuspojave lijekova proizašle iz zaprimljenih prijava otrovanja lijekovima koje je HALMED-u proslijedio Centar za kontrolu otrovanja Instituta za medicinska istraživanja i medicinu rada (IMI)
- prijave sumnji na nuspojave lijekova iz postmarketinških neintervencijskih ispitivanja koje su HALMED-u proslijedili nositelji odobrenja za stavljanje lijeka u promet.
U ukupan broj prijava sumnji na nuspojave koje su detaljno obrađene u Izvješću nisu uključene sljedeće prijave:
- 453 prijave otrovanja jednim ili više lijekova ili slučajne izloženosti lijeku koje je HALMED zaprimio od IMI-ja, a koje nisu sadržavale podatak o nuspojavi lijeka.
- 11 prijava primjene lijeka izvan uvjeta odobrenja za stavljanje lijeka u promet, medikacijskih pogrešaka, predoziranja, slučajne izloženosti lijeku i izloženosti lijeku u trudnoći, koje nisu rezultirale nuspojavom.
- 62 prijave sumnji na nuspojave iz kliničkih ispitivanja u Republici Hrvatskoj, što uključuje i nastavna izvješća o ozbiljnim neočekivanim nuspojavama (SUSAR, engl. Suspected Unexpected Serious Adverse Reaction). O navedenim nuspojavama HALMED redovito izvještava Središnje etičko povjerenstvo kao tijelo nadležno za davanje mišljenja u postupku davanja odobrenja za klinička i neintervencijska ispitivanja u Hrvatskoj.
2. Prijave sumnji na nuspojave u 2020. godini
Sukladno odredbama Zakona o lijekovima i Pravilnika o farmakovigilanciji, nuspojava je svaka štetna i neželjena reakcija na lijek, pri čemu se nuspojavom smatraju i štetni i neželjeni učinci lijeka koji su posljedica primjene lijeka izvan uvjeta odobrenja za stavljanje lijeka u promet, pogrešne uporabe lijeka, zlouporabe lijeka, predoziranja, medikacijskih pogrešaka i profesionalne izloženosti lijeku.
Tijekom 2020. godine HALMED je zaprimio ukupno 4022 prijave sumnji na nuspojave lijekova u Republici Hrvatskoj. Od navedenog broja, 126 prijava proizašlo je iz postmarketinških neintervencijskih ispitivanja, dok je 3896 prijava prikupljeno spontanim prijavljivanjem te iz objavljenih literaturnih podataka. Spontane prijave odnose se na prijave zdravstvenih radnika i pacijenata/korisnika lijeka koje je HALMED zaprimio izravno odnosno koje su mu proslijeđene od nositelja odobrenja za stavljanje lijeka u promet, Hrvatskog zavoda za javno zdravstvo (HZJZ) te Centra za kontrolu otrovanja Instituta za medicinska istraživanja i medicinu rada (IMI). Prijave iz literaturnih podataka odnose se na prijave koje HALMED-u temeljem praćenja dostupne medicinske literature prosljeđuju nositelji odobrenja za stavljanje lijeka u promet i Europska agencija za lijekove (EMA) putem svojeg MLM servisa.
Prijave koje su zaprimljene u 2020. godini (4022) sadržavale su ukupno 13041 prijavljenu nuspojavu. Broj nuspojava veći je od broja zaprimljenih prijava jer svaka prijava može sadržavati jednu ili više nuspojava.
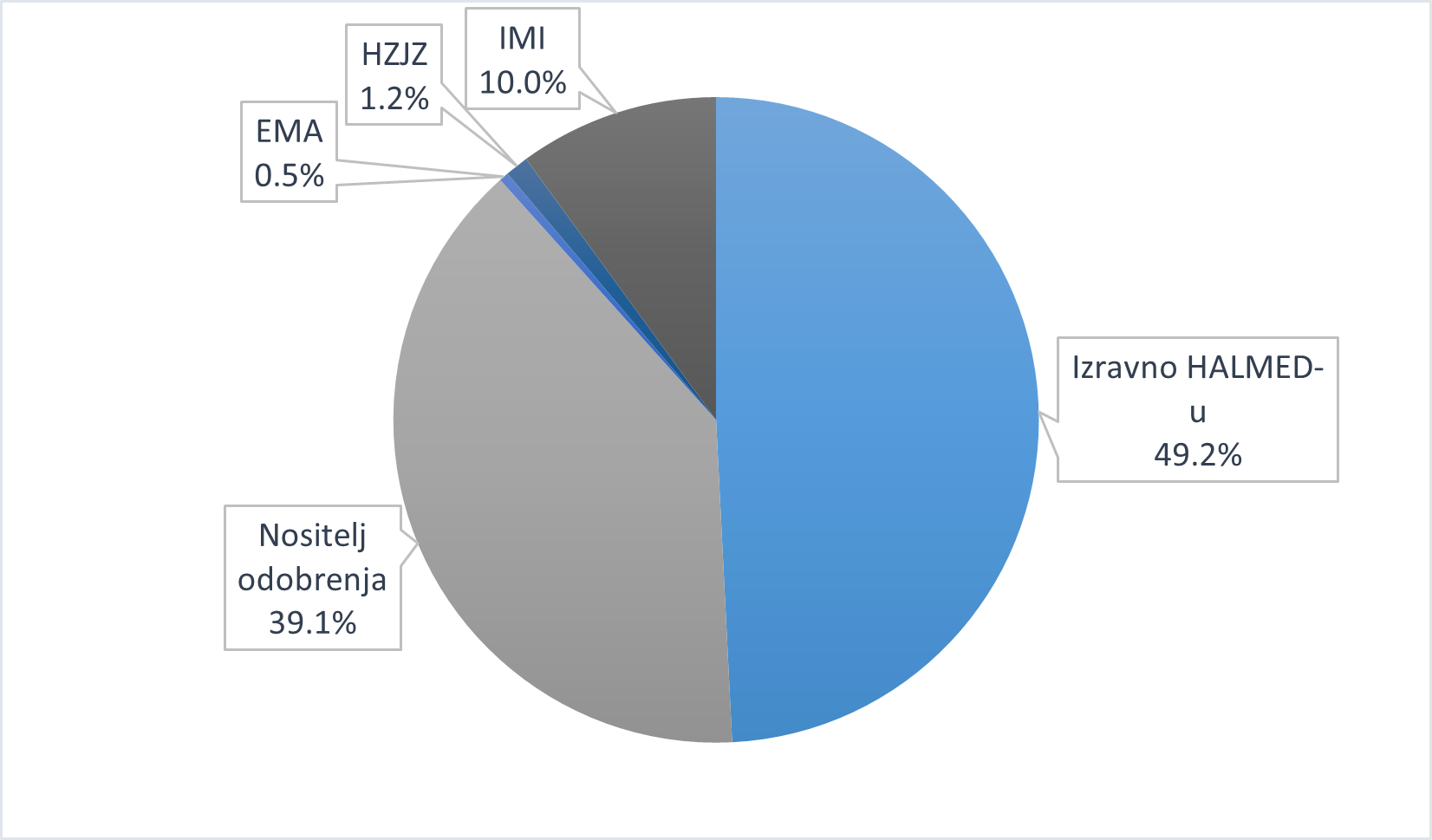
U 2020. godini zdravstveni radnici i pacijenti/korisnici lijeka izravno su HALMED-u uputili 1979 prijava sumnji na nuspojave, nositelji odobrenja proslijedili su HALMED-u 1574 prijave, od HZJZ-a je zaprimljeno 47 prijava, a od IMI-ja 403 prijave, dok je EMA putem MLM servisa HALMED-u proslijedila 19 prijava. Udio prijava prema pošiljatelju prikazan je na
Slici 1.
Slika 1. Udio prijava prema pošiljatelju
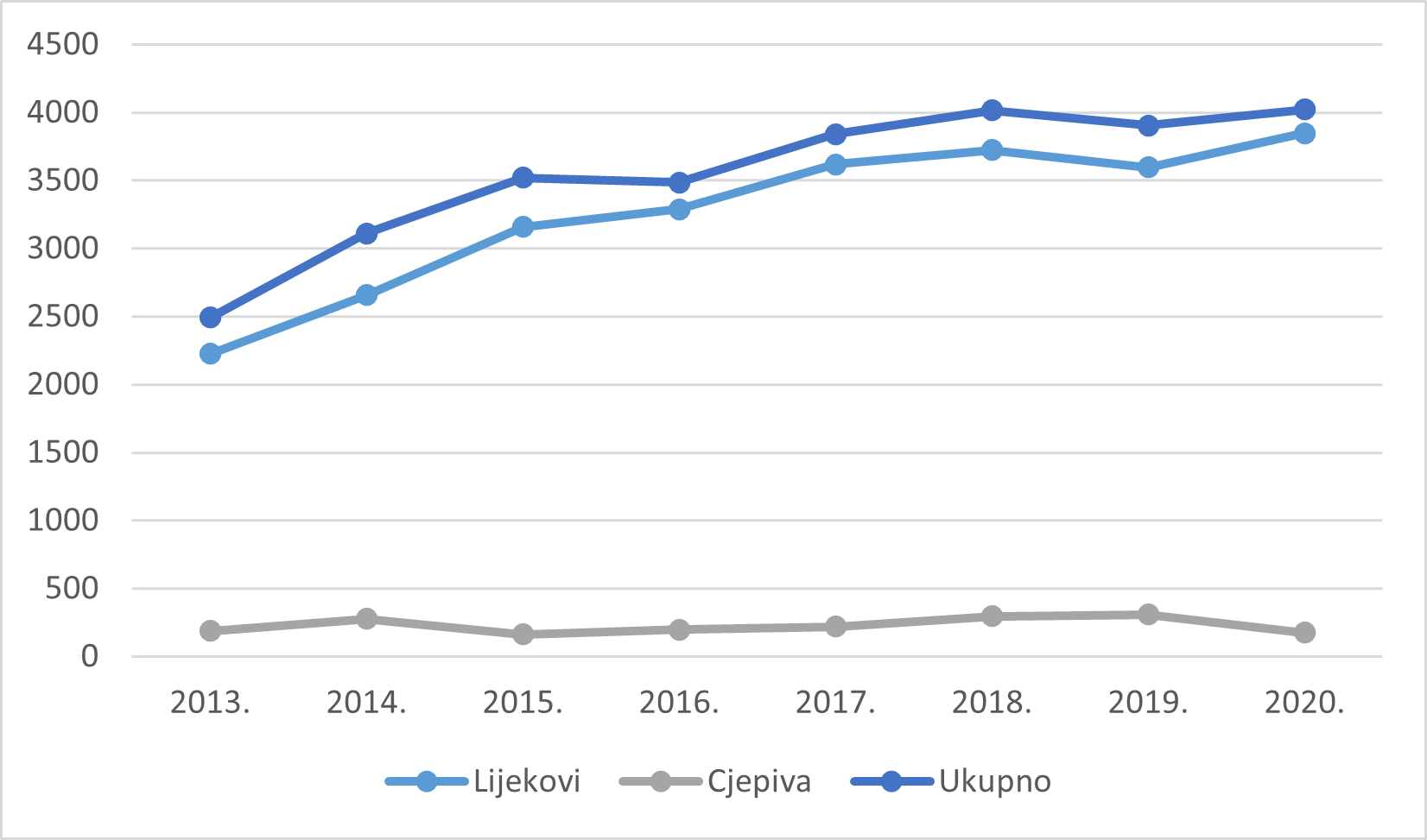
U nastavku je prikazan ukupan broj prijava sumnji na nuspojave koje je HALMED zaprimio u 2020. godini (Tablica 1.), pri čemu je izdvojeno prikazan broj prijava sumnji na nuspojave cjepiva u odnosu na ostale skupine lijekova. Dodatno, prikazano je kretanje ukupnog broja prijava sumnji na nuspojave u razdoblju od 2013. do 2020. godine (Tablica 2.) te broja prijava sumnji na nuspojave lijekova i cjepiva u Republici Hrvatskoj u istome razdoblju (Tablica 3.). Također, napravljen je i usporedni prikaz ukupnog broja prijava sumnji na nuspojave te prijava sumnji na nuspojave lijekova i cjepiva (Slika 2.).
Tablica 1. Prijave sumnji na nuspojave lijekova i cjepiva u 2020. godini
| Skupina | Lijekovi | Cjepiva | UKUPNO |
|---|---|---|---|
| Broj prijava | 3847 | 175 | 4022 |
Tablica 2. Kretanje ukupnog broja prijava sumnji na nuspojave u Republici Hrvatskoj u razdoblju od 2013. do 2020. godine
| Godina | 2013. | 2014. | 2015. | 2016. | 2017. | 2018. | 2019. | 2020. |
|---|---|---|---|---|---|---|---|---|
| Broj prijava | 2491 | 3112 | 3519 | 3486 | 3840 | 4017 | 3904 | 4022 |
Tablica 3. Kretanje broja prijava sumnji na nuspojave na lijekove i cjepiva u Republici Hrvatskoj u razdoblju od 2013. do 2020. godine
| Godina | 2013. | 2014. | 2015. | 2016. | 2017. | 2018. | 2019. | 2020. |
|---|---|---|---|---|---|---|---|---|
| Lijekovi | 2224 | 2658 | 3158 | 3289 | 3620 | 3722 | 3595 | 3847 |
| Cjepiva | 188 | 276 | 162 | 197 | 220 | 295 | 309 | 175 |
Slika 2. Kretanje ukupnog broja prijava sumnji na nuspojave u Republici Hrvatskoj u razdoblju od 2013. do 2020. godine
Slika 3. Kretanje broja prijava sumnji na nuspojave zaprimljenih u 2020. godini po mjesecima u odnosu na prosjek
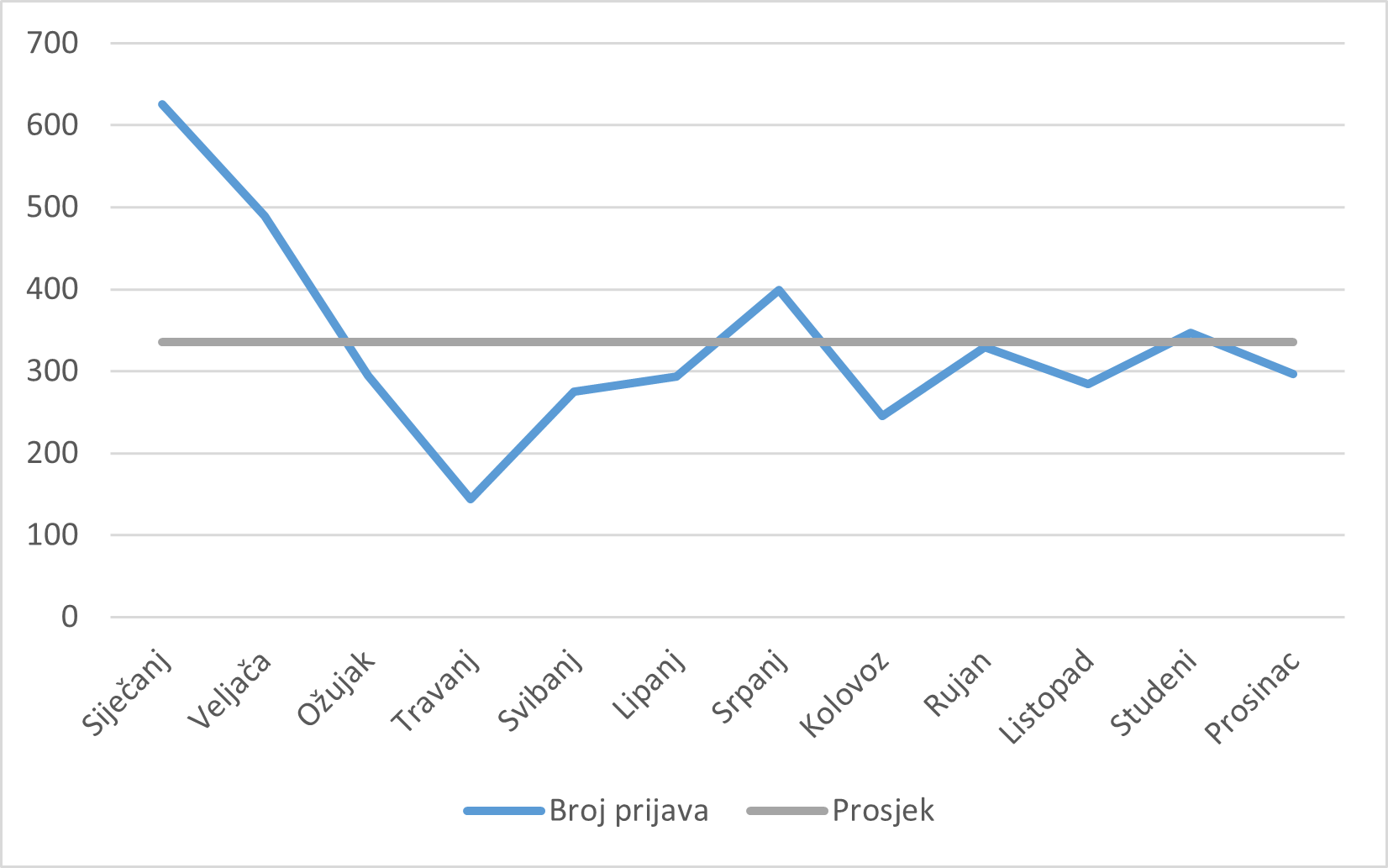
Slika 3. prikazuje kretanje broja prijava sumnji na nuspojave u 2020. godini po mjesecu u kojem su prijave zaprimljene u odnosu na prosječan broj prijava sumnji na nuspojave po mjesecu u 2020. godini. Najveći broj prijava sumnji na nuspojave (626) zaprimljen je u siječnju 2020. godine, što je posljedica zaprimanja povećanog broja prijava sumnji na nuspojave lijeka Euthyrox nakon promjene formulacije lijeka. Detalji o zaprimljenim prijavama sumnji na nuspojave lijeka Euthyrox opisani su u dijelu 2.2.8. izvješća.
Ključni zaključci o prijavama sumnji na nuspojave lijekova u 2020. godini:
- HALMED je u 2020. godini zaprimio ukupno 4022 prijave sumnji na nuspojave lijekova u Republici Hrvatskoj.
- Ukupan broj prijava sumnji na nuspojave lijekova u 2020. godini veći je za 3% u odnosu na 2019. godinu (4022 prijave u 2020. godini u odnosu na 3904 prijave u 2019. godini). Ukupan broj prijava sumnji na nuspojave kontinuirano je na visokoj razini već dugi niz godina, uzimajući u obzir ukupan broj prijava na milijun stanovnika godišnje. Opaženi trend ukazuje na to da su dugogodišnje aktivnosti HALMED-a rezultirale razvojem trajne svijesti o važnosti prijavljivanja sumnji na nuspojave.
- Najveći udio prijava zaprimljen je od liječnika (53,9%), kao i prethodnih godina. Slijede pacijenti/korisnici lijeka s udjelom od 23,6%, dok se na trećem mjestu nalaze ljekarnici s udjelom prijava od 17,6%. Prijave sumnji na nuspojave zaprimljene od pacijenata/korisnika lijeka u 2020. godini porasle su za 91,5% u odnosu na 2019. godinu, što je najvećim dijelom posljedica pojačanog zaprimanja prijava sumnji na nuspojave za novu formulaciju lijeka Euthyrox. Zaprimljene prijave sumnji na nuspojave za novu formulaciju lijeka Euthyrox nisu odudarale u odnosu na prijave za staru formulaciju lijeka te iz njih nisu identificirana nova sigurnosna pitanja.
- Od ukupnog broja prijava sumnji na nuspojave zaprimljenih u 2020. godini, nositelji odobrenja za stavljanje lijeka u promet proslijedili su HALMED-u 39,1% prijava, koje su zaprimili od zdravstvenih radnika i pacijenata/korisnika lijeka. Broj prijava zaprimljenih od nositelja odobrenja za stavljanje lijeka u promet u 2020. godini veći je za 6,6% u odnosu na 2019. godinu.
- Udio prijava koje sadrže nuspojave koje ispunjavaju najmanje jedan od kriterija prema kojima se klasificiraju kao ozbiljne iznosi 44%, što je niže u odnosu na udio prijava koje sadrže nuspojave koje ne ispunjavaju niti jedan od tih kriterija. Udio prijava koje se klasificiraju kao ozbiljne u kontinuiranom je porastu od 2015. godine. Nuspojave koje se ne svrstavaju u kategoriju ozbiljnih nuspojava mogu biti teške, a u pojedinim slučajevima i negativno utjecati na obavljanje svakodnevnih aktivnosti te posljedično smanjiti kvalitetu života pacijenta/korisnika lijeka. Njihovim prijavljivanjem također se pridonosi boljem razumijevanju utjecaja nuspojava na kvalitetu života pacijenata/korisnika lijeka te unaprjeđenju sigurnosti primjene lijekova.
- Broj prijava sumnji na nuspojave zaprimljenih elektroničkim putem (putem on-line aplikacije i mobilne aplikacije) je u 2020. godini porastao za 21,2% u odnosu na 2019. godinu, dok se broj prijava sumnji na nuspojave zaprimljenih poštom u 2020. godini smanjio za 63,9% u odnosu na 2019. godinu. Ovi podaci ukazuju na nastavak trenda porasta zaprimanja prijava sumnji na nuspojave elektroničkim putem, odnosno trenda pada zaprimanja prijava sumnji na nuspojave putem pošte, što HALMED kontinuirano potiče. Prednosti elektroničkog prijavljivanja sumnji na nuspojave uključuju, između ostalog, izravan unos podataka u bazu, čime se smanjuje mogućnost pogreške uzrokovane ljudskim faktorom prilikom ručnog unosa podataka u bazu te kraće vrijeme potrebno za obradu prijava. Dodatno, prijavitelji trebaju utrošiti znatno manje vremena prilikom prijavljivanja sumnji na nuspojave, a postupak prijavljivanja elektroničkim putem je pojednostavljen zbog mogućnosti korištenja unaprijed definiranih opcija u padajućim izbornicima. Stoga se zdravstveni radnici i pacijenti/korisnici lijeka i dalje pozivaju na prijavljivanje sumnji na nuspojave elektroničkim putem, kao i prethodnih godina.
- HALMED je u 2020. godini zaprimio 175 prijava sumnji na nuspojave cjepiva. Broj prijava sumnji na nuspojave cjepiva u 2020. godini niži je u odnosu na 2019. godinu. Najčešće prijavljene nuspojave cjepiva su očekivane, odnosno navedene su u odobrenim dokumentima o lijeku (sažetku opisa svojstava lijeka i uputi o lijeku) i karakteristične su za primjenu cjepiva (primjerice, reakcije na mjestu primjene kao što su crvenilo, oteklina i/ili bol), te iz njih nisu identificirana nova sigurnosna pitanja.
- HALMED je u 2020. godini od IMI-ja zaprimio 856 prijava otrovanja lijekovima. Ukupno 403 prijave sadržavale su podatak o nuspojavi lijeka, dok 453 prijave nisu sadržavale podatak o nuspojavi lijeka ili je u njima bilo jasno navedeno da nije došlo do nuspojave. Prijave koje sadrže podatak o nuspojavi lijeka obrađene su i prikazane u Izvješću kao dio ukupnog broja prijava sumnji na nuspojave lijekova zaprimljenih u 2020. godini. Prijave koje ne sadrže podatak o nuspojavi lijeka nisu uključene u obradu kao dio ukupnog broja prijava sumnji na nuspojave zaprimljenih u 2020. godini, ali su prikazane u dijelu 2.3.2. Izvješća. U sklopu farmakovigilancijskih aktivnosti HALMED takve prijave također evidentira i ocjenjuje te prosljeđuje nositeljima odobrenja za stavljanje lijeka u promet, uzimajući u obzir to da one predstavljaju važan izvor podataka u praćenju cjelokupnog sigurnosnog profila lijeka. Takve prijave najčešće sadrže podatke o primjeni lijeka izvan uvjeta odobrenja za stavljanje lijeka u promet, pogrešnoj uporabi lijeka, zlouporabi lijeka, predoziranju, medikacijskim pogreškama i profesionalnoj izloženosti lijeku.
- Kada se broju prijava sumnji na nuspojave lijekova zaprimljenih u 2020. godini (4022) pridoda broj prijava koje nisu uključene u obradu kao dio ukupnog broja, odnosno 453 prijave otrovanja lijekovima zaprimljene od IMI-ja i 11 prijava zaprimljenih od nositelja odobrenja i zdravstvenih radnika koje ne sadrže podatak o nuspojavi lijeka, ukupan broj prijava koje je HALMED zaprimio i ocijenio u 2020. godini iznosi 4486. Ukupan broj prijava u 2020. godini veći je za 5,2% u odnosu na 2019. godinu.
2.1. Izvori prijava i načini prijavljivanja
Liječnici su u 2020. godini uputili 2168 prijava sumnji na nuspojave, što čini udio od 53,9% u ukupnom broju zaprimljenih prijava. Liječnici su i u 2020. godini, kao i prethodnih godina, bili najzastupljenija skupina prijavitelja. U odnosu na 2019. godinu, kada je od ove skupine prijavitelja zaprimljeno 2115 prijava (54,2%), broj prijava zaprimljenih od liječnika se povećao, dok je udio prijava koje su liječnici uputili neznatno manji.
Broj prijava zaprimljenih od ljekarnika u 2020. godini iznosio je 708, što čini udio od 17,6% u ukupnom broju zaprimljenih prijava. U odnosu na 2019. godinu, kada je zaprimljeno 937 (24%) prijava, broj i udio prijava zaprimljenih od ljekarnika se smanjio.
U 2020. godini HALMED je izravno te putem nositelja odobrenja zaprimio 948 prijava od pacijenata/korisnika lijeka, što čini udio od 23,6% ukupnog broja zaprimljenih prijava. Broj prijava od pacijenata/korisnika lijeka u 2020. godini povećao se za 91,5% u odnosu na 2019. godinu, kada je od pacijenata/korisnika lijeka zaprimljeno 495 prijava. Navedeno je posljedica zaprimanja povećanog broja prijava sumnji na nuspojave za novu formulaciju lijeka Euthyrox.
Slika 4. prikazuje kretanje broja prijava sumnji na nuspojave prema prijaviteljima u razdoblju od 2013. do 2020. godine. U Tablici 4. prikazani su podaci o zaprimljenim prijavama sumnji na nuspojave prema struci prijavitelja u 2020. godini.
Slika 4. Kretanje broja prijava prema prijaviteljima u razdoblju od 2013. do 2020. godine
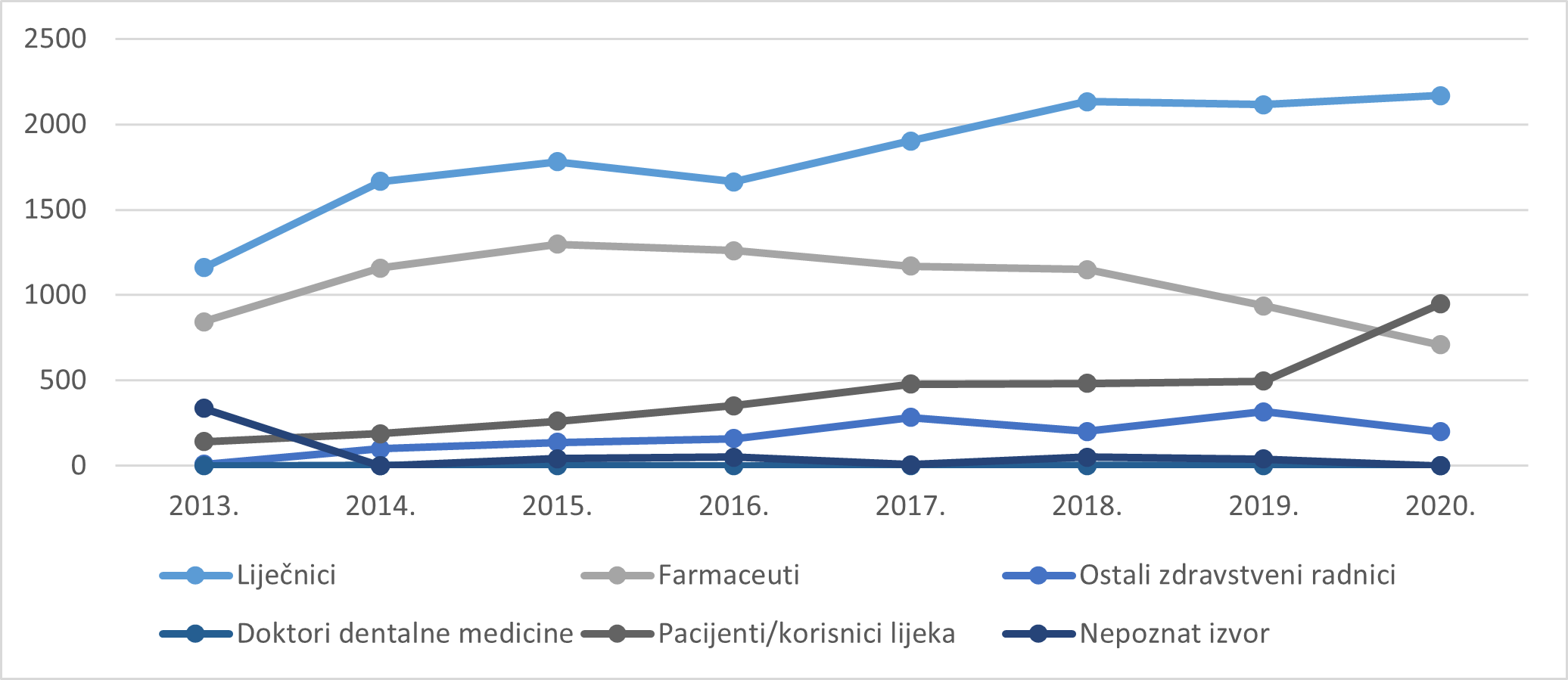
Tablica 4. Prijave sumnji na nuspojave u 2020. godini prema struci prijavitelja
| Izvor prijave | Broj prijava |
|---|---|
| Liječnici | 2168 |
| Farmaceuti | 708 |
| Ostali zdravstveni radnici | 198 |
| Pacijenti | 948 |
| UKUPNO | 4022 |
Slika 5. prikazuje kretanje broja pojedinačnih prijavitelja - liječnika i farmaceuta u razdoblju od 2013. do 2020. godine. Važno je napomenuti kako se navedeni podaci temelje na prijavama u kojima je bilo moguće identificirati kojoj skupini zdravstvenih radnika pripada prijavitelj te samo na prijavama koje su poslane izravno HALMED-u ili su proslijeđene HALMED-u od HZJZ-a. Zbog zaštite identiteta prijavitelja nositelji odobrenja i IMI nisu dužni dostaviti HALMED-u osobne podatke prijavitelja.
Slika 5. Kretanje broja pojedinačnih prijavitelja - liječnika i farmaceuta u razdoblju od 2013. do 2020. godine
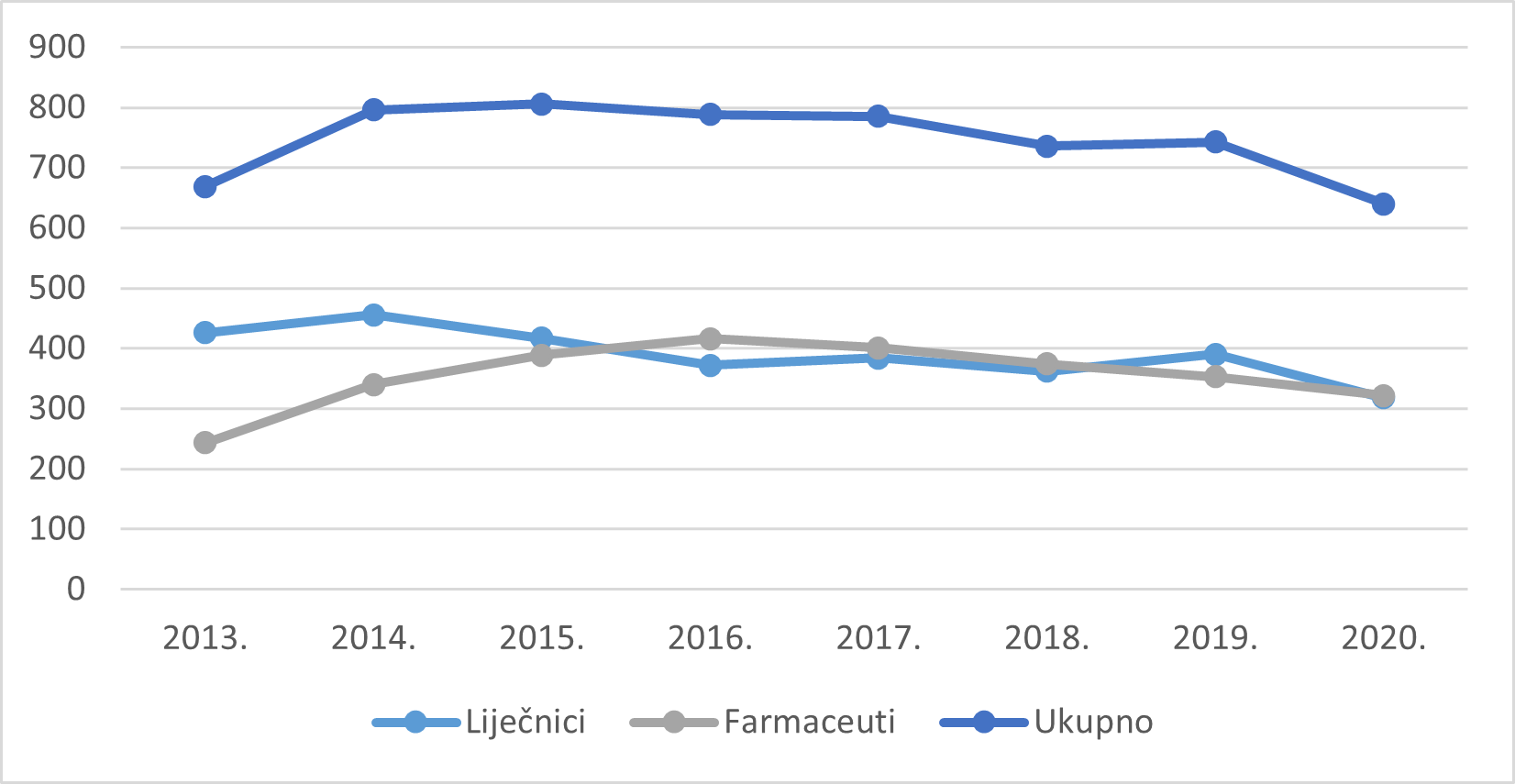
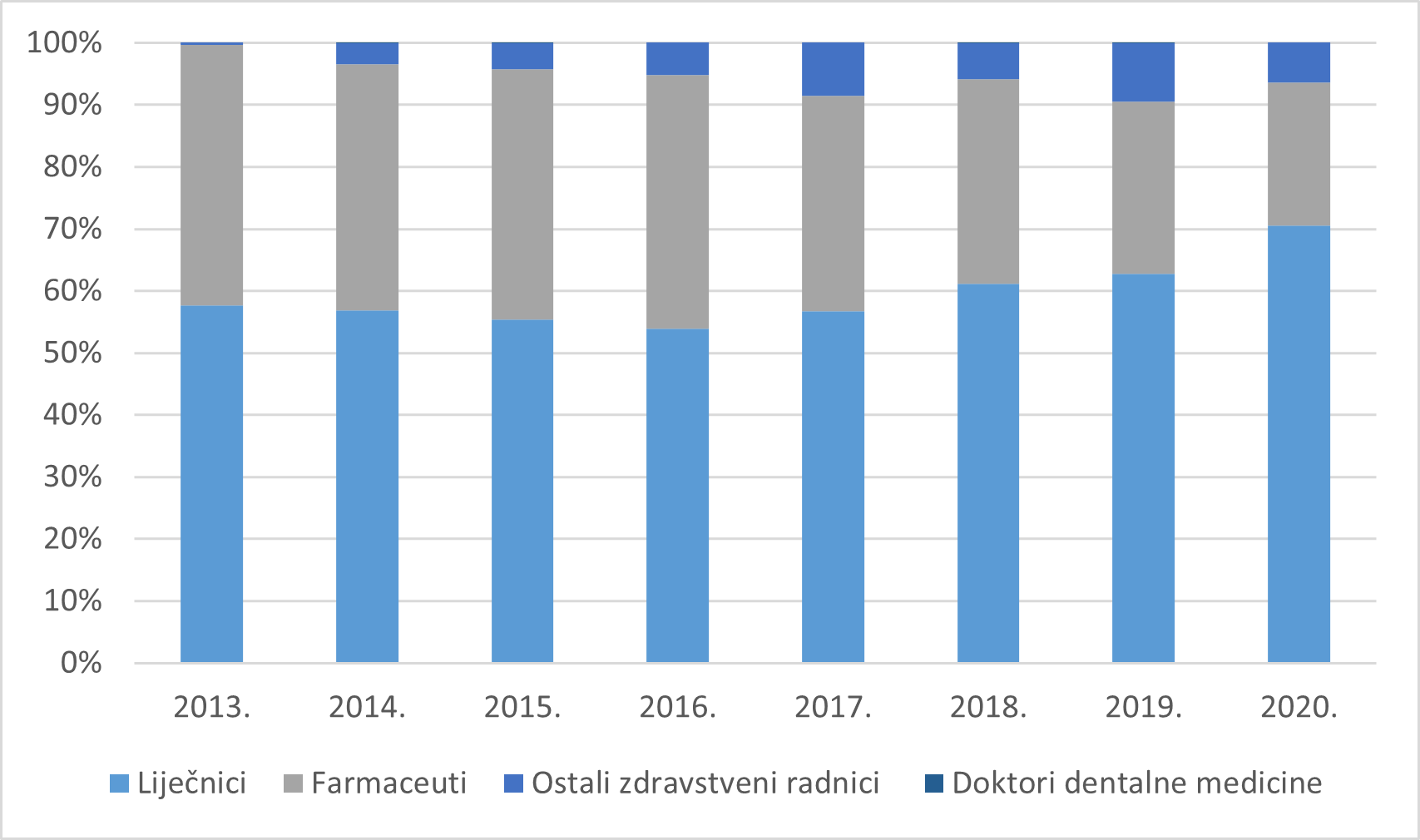
Slika 6. prikazuje udio prijava prema struci prijavitelja - zdravstvenih radnika u razdoblju od 2013. do 2020. godine. Najveći broj prijava kontinuirano se u proteklih osam godina zaprima od liječnika.
Slika 6. Udio prijava prema struci prijavitelja - zdravstvenih radnika u razdoblju od 2013. do 2020. godine
Zdravstveni radnici su u 2020. godini uputili 3074 prijave sumnji na nuspojave. Tablica 5. prikazuje broj prijava sumnji na nuspojave u 2020. godini prema vrsti zdravstvene ustanove iz koje su upućene.
Tablica 5. Broj prijava sumnji na nuspojave prema zdravstvenim ustanovama u 2020. godini
| Zdravstvena ustanova | Broj prijava |
|---|---|
| Ljekarna | 235 |
| Klinička bolnica ili klinički bolnički centar | 604 |
| Ordinacija obiteljske medicine | 237 |
| Opća bolnica | 283 |
| Zavod za javno zdravstvo | 48 |
| Specijalna bolnica | 40 |
| Pedijatrijska ordinacija | 16 |
| Zavod za hitnu medicinu | 5 |
| Ostalo* | 23 |
| Nepoznato | 1583 |
| UKUPNO PRIJAVA | 3074 |
* prijave iz zdravstvenih ustanova koje nisu obuhvaćene drugim navedenim kriterijima, a koje obuhvaćaju, primjerice, prijave pristigle iz ostalih specijalističkih ordinacija
Slika 7. Udio pojedinih zdravstvenih ustanova u broju prijava sumnji na nuspojave od zdravstvenih radnika u 2020. godini
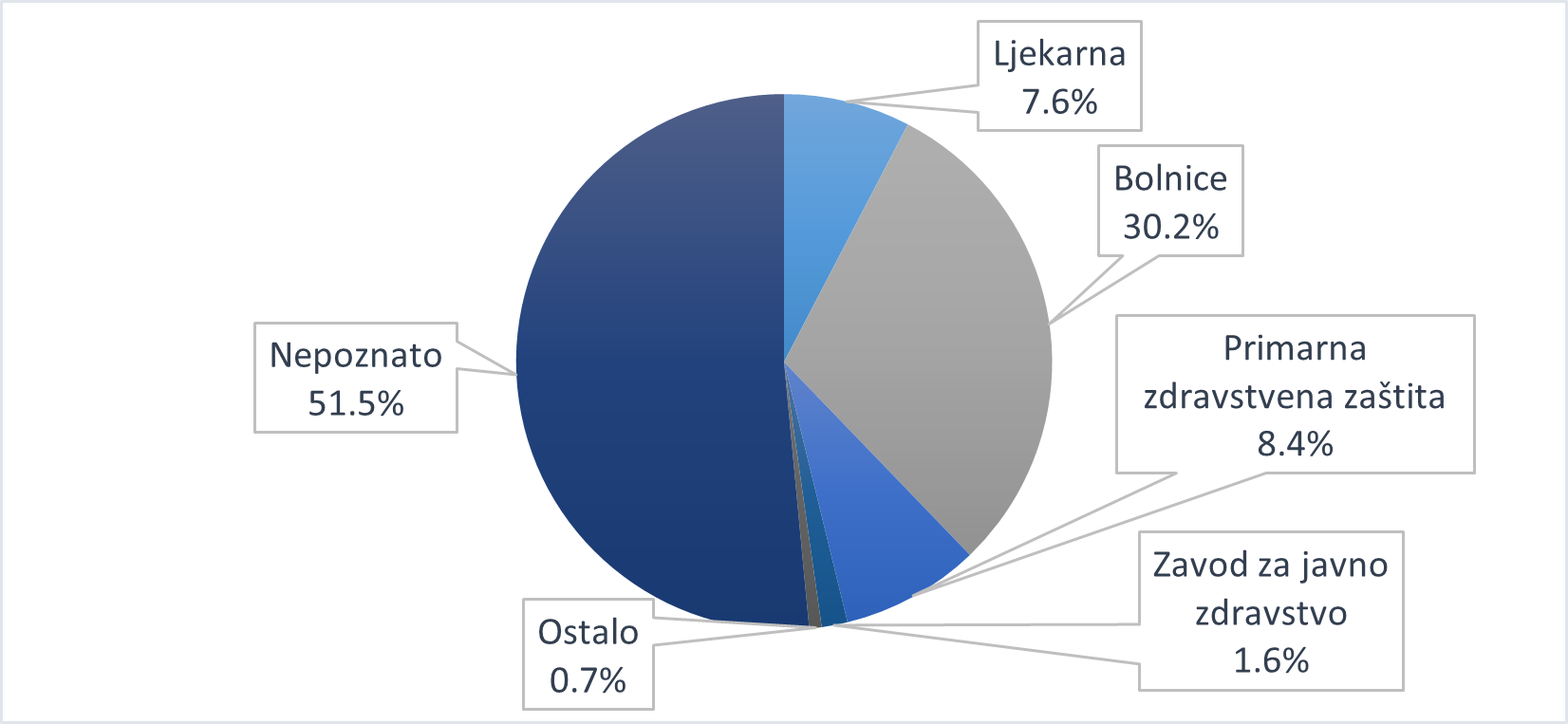
Slika 7. prikazuje udio pojedinih zdravstvenih ustanova u broju prijava sumnji na nuspojave zaprimljenih od zdravstvenih radnika u 2020. godini. Kategorijom Primarna zdravstvena zaštita obuhvaćene su prijave zaprimljene iz ordinacija obiteljske medicine, pedijatrijskih ordinacija te zavoda za hitnu medicinu. Kategorijom Bolnice obuhvaćene su prijave zaprimljene iz općih i specijalnih bolnica te kliničkih bolnica i kliničkih bolničkih centara. Posebno su navedene kategorije za zavode za javno zdravstvo, koji sudjeluju u sustavu prijavljivanja sumnji na nuspojave cjepiva, te ljekarne. U prijavama nije identificirano 51,5% ustanova, što je manje u odnosu na 2019. godinu kada je taj udio iznosio 57,3%. Razlog za navedeno moguće je objasniti činjenicom da nositelji odobrenja i IMI zbog zaštite osobnih podataka nisu dužni proslijediti navedene podatke HALMED-u. Dodatno, prijavitelji također nisu dužni navesti ustanovu iz koje prijavljuju sumnju na nuspojavu jer navedeni podatak ne pripada minimumu kriterija za valjanost prijave.
Prosječan broj prijava za Republiku Hrvatsku u 2020. godini iznosio je 9,39 na 10000 stanovnika. U Tablici 6. prikazan je broj prijava po pojedinim županijama u 2020. godini.
Tablica 6. Broj prijava po županijama u 2020. godini
| Županija | Ukupan broj prijava u 2020. godini |
|---|---|
| I. Zagrebačka | 14 |
| II. Krapinsko-zagorska | 22 |
| III. Sisačko-moslavačka | 47 |
| IV. Karlovačka | 41 |
| V. Varaždinska | 35 |
| VI. Koprivničko-križevačka | 33 |
| VII. Bjelovarsko-bilogorska | 17 |
| VIII. Primorsko-goranska | 111 |
| IX. Ličko-senjska | 14 |
| X. Virovitičko-podravska | 7 |
| XI. Požeško-slavonska | 10 |
| XII. Brodsko-posavska | 48 |
| XIII. Zadarska | 51 |
| XIV. Osječko-baranjska | 59 |
| XV. Šibensko-kninska | 27 |
| XVI. Vukovarsko-srijemska | 25 |
| XVII. Splitsko-dalmatinska | 155 |
| XVIII. Istarska | 111 |
| XIX. Dubrovačko-neretvanska | 37 |
| XX. Međimurska | 26 |
| XXI. Grad Zagreb | 489 |
| Nepoznato | 2643 |
| UKUPNO | 4022 |
HALMED je i u 2020. godini iz svake županije zaprimio barem jednu prijavu sumnje na nuspojavu. Najviše prijava zaprimljeno je, kao i 2019. godine, s područja Grada Zagreba - 489. Splitsko-dalmatinska županija nalazi se na drugom mjestu sa 155 prijava, dok se na trećem mjestu nalaze Primorsko-goranska i Istarska županija sa 111 prijava. U kategoriju Nepoznato svrstane su 2643 prijave, što čini udio od 65,7%. Ovaj postotak moguće je objasniti činjenicom da nositelji odobrenja i IMI zbog zaštite osobnih podataka nisu dužni proslijediti HALMED-u podatak o adresi prijavitelja.
Zdravstveni radnici i pacijenti/korisnici lijeka sumnju na nuspojavu lijeka mogu prijaviti putem on-line aplikacije dostupne na internetskoj stranici HALMED-a, putem mobilne aplikacije ili putem Obrasca za prijavu sumnje na nuspojavu dostupnog na internetskoj stranici HALMED-a, koji je moguće poslati elektroničkom poštom, telefaksom, poštom ili dostaviti osobno na adresu HALMED-a.
U prikupljanju prijava sumnji na nuspojave sudjeluju i nositelji odobrenja za stavljanje lijeka u promet koji su sve prijave koje zaprime dužni proslijediti HALMED-u elektronički putem baze EudraVigilance. Putem baze EudraVigilance prijave sumnji na nuspojave koje su identificirane u medicinskoj literaturi za određene lijekove prosljeđuje i Europska agencija za lijekove, koristeći se svojom uslugom za praćenje medicinske literature za određene lijekove (EMA-in MLM servis).
Tablica 7. prikazuje ukupan broj prijava u 2020. godini u odnosu na 2019. godinu prema načinu prijavljivanja, dok Slika 8. prikazuje udio prijava u 2020. godini prema načinu prijavljivanja.
Tablica 7. Broj prijava prema načinu prijavljivanja u 2020. godini u odnosu na 2019. godinu
| Način prijavljivanja | Broj prijava u 2019. | Broj prijava u 2020. |
|---|---|---|
| EudraVigilance | 1486 | 1593 |
| On-line aplikacija | 1073 | 1316 |
| Mobilna aplikacija | 130 | 141 |
| E-pošta | 600 | 745 |
| Telefaks | 161 | 64 |
| Pošta | 454 | 163 |
| UKUPNO | 3904 | 4022 |
Slika 8. Udio prijava prema načinu prijavljivanja u 2020. godini
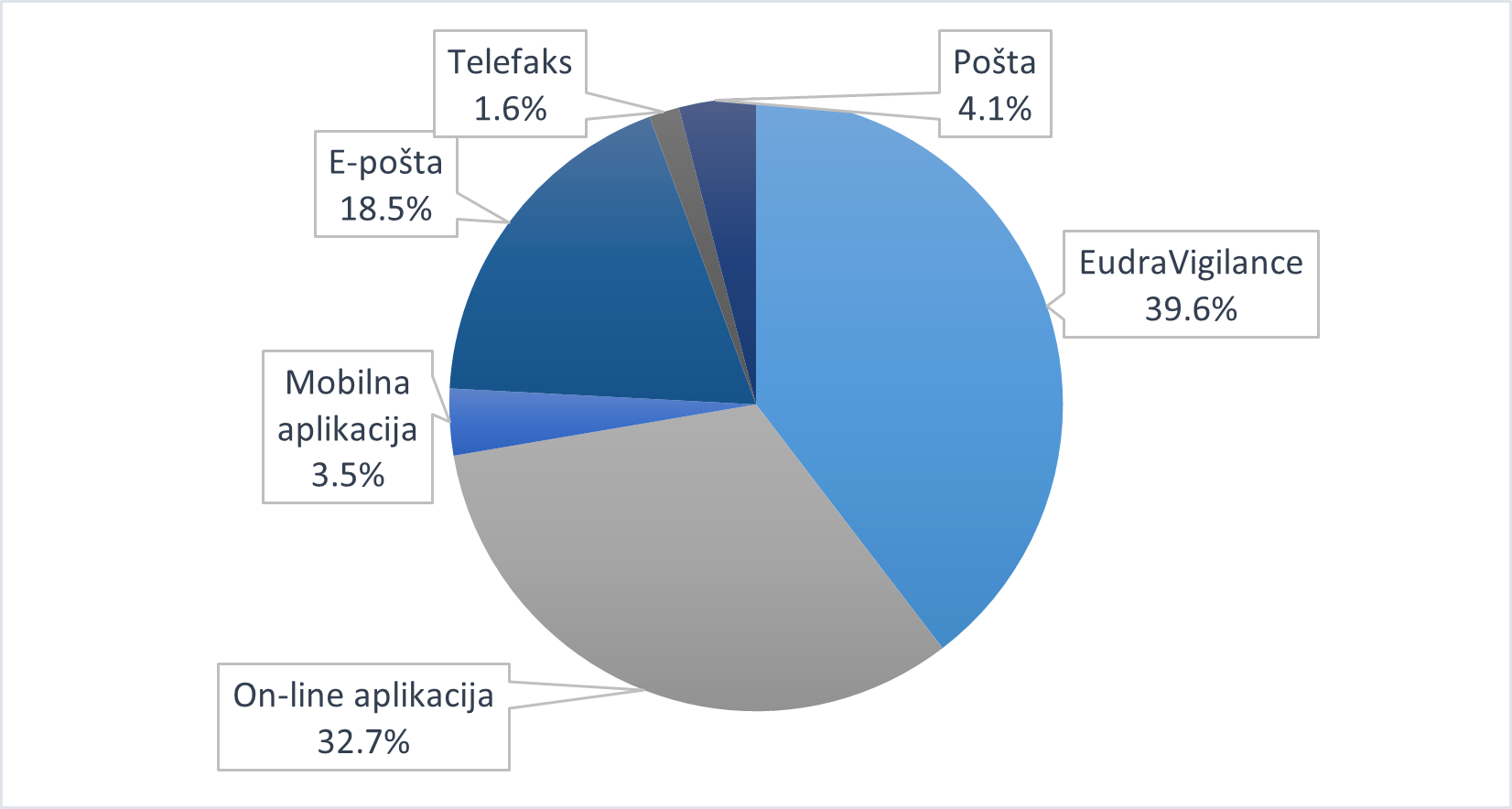
U 2020. godini 1316 prijava zaprimljeno je putem on-line aplikacije, a 141 prijava putem mobilne aplikacije, što zajedno čini udio od 36,2% u ukupnom broju prijava, odnosno udio od 73,6% u broju prijava zaprimljenih izravno od zdravstvenih radnika i pacijenata/korisnika lijeka. Trend porasta prijava zaprimljenih elektroničkim putem (putem on-line aplikacije i mobilne aplikacije) nastavio se i u 2020. godini; broj prijava porastao je za 21,1% (1457 prijava u 2020. godini u odnosu na 1203 prijave u 2019. godini). On-line aplikacija namijenjena je prvenstveno pacijentima/korisnicima lijeka, međutim u značajnoj mjeri koriste je i zdravstveni radnici; od 1316 prijava zaprimljenih putem on-line aplikacije, 972 prijave uputili su zdravstveni radnici, a 344 prijave pacijenti/korisnici lijeka.
U 2020. godini 163 prijave zaprimljene su poštom, što čini udio od 4,1% u ukupnom broju prijava. Trend smanjenja broja prijava zaprimljenih poštom nastavio se i u 2020. godini; broj prijava smanjen je za 64,1% (163 prijave u 2020. godini u odnosu na 454 prijave u 2019. godini). Od 163 prijave zaprimljene poštom, zdravstveni radnici i pacijenti/korisnici lijeka izravno su poslali HALMED-u 103 prijave, što čini udio od 5,2% u ukupnom broju prijava koje su zdravstveni radnici i pacijenti/korisnici lijeka izravno poslali HALMED-u.
U 2020. godini nositelji odobrenja za stavljanje lijeka u promet proslijedili su HALMED-u 1574 prijave, što čini udio od 39,1% u ukupnom broju prijava. U odnosu na 2019. godinu, kada su nositelji odobrenja za stavljanje lijeka u promet HALMED-u proslijedili 1477 prijava, zabilježen je porast broja prijava od 6,6%. Dodatno, u 2020. godini od EMA-e je putem MLM servisa zaprimljeno 19 prijava sumnji na nuspojave, koje su identificirane u medicinskoj literaturi za određene lijekove. Navedene nuspojave od nositelja odobrenja i EMA-e zaprimaju se elektronički putem baze EudraVigilance, putem koje su u 2020. godini ukupno zaprimljene 1593 prijave.
2.2. Karakteristike prijava sumnji na nuspojave
Najzastupljenija skupina prema anatomsko-terapijsko-kemijskoj (ATK) klasifikaciji lijekova u 2020. godini je skupina L (lijekovi za liječenje zloćudnih bolesti i imunomodulatori), na drugom mjestu nalazi se skupina N (lijekovi koji djeluju na živčani sustav), dok se na trećem mjestu nalazi skupina H (sustavni hormonski lijekovi). Skupine L i N bile su najzastupljenije i u 2019. godini, a u 2020. godini po prvi se puta među najzastupljenijim skupinama pojavila skupina H. Skupini H pripadaju lijekovi koji sadrže levotiroksinnatrij, djelatnu tvar lijeka Euthyrox, za koji je početkom godine zaprimljen povećan broj prijava sumnji na nuspojave.
Ukupan broj lijekova za koje je prijavljena sumnja na nuspojavu veći je od ukupnog broja prijava jer je u jednoj prijavi sumnje na nuspojavu moguće navesti jedan ili više lijekova pod sumnjom, a moguća je i interakcija između dvaju ili više lijekova (Tablica 8.).
Tablica 8. Broj lijekova za koje je u 2020. godini prijavljena sumnja na nuspojavu prema ATK klasifikaciji
| ATK klasifikacija | 2020. |
|---|---|
| ATK 1. razina A skupina (probavni sustav) | 259 |
| ATK 1. razina B skupina (učinak na krv) | 277 |
| ATK 1. razina C skupina (kardiovaskularni sustav) | 500 |
| ATK 1. razina D skupina (dermatici) | 33 |
| ATK 1. razina G skupina (urogenitalni sustav i spolni hormoni) | 98 |
| ATK 1. razina H skupina (sustavni hormonski lijekovi) | 816 |
| ATK 1. razina J skupina (liječenje sustavnih infekcija) | 521 |
| ATK 1. razina L skupina (citostatici) | 1451 |
| ATK 1. razina M skupina (koštano-mišićni sustav) | 178 |
| ATK 1. razina N skupina (živčani sustav) | 1026 |
| ATK 1. razina P skupina (parazitne infekcije) | 6 |
| ATK 1. razina R skupina (respiratorni sustav) | 115 |
| ATK 1. razina S skupina (pripravci za osjetila) | 34 |
| ATK 1. razina V skupina (različito) | 79 |
| UKUPAN BROJ LIJEKOVA | 5393 |
Slika 9. Kretanje broja prijava sumnji na nuspojave za pojedine skupine lijekova prema ATK klasifikaciji u razdoblju od 2013. do 2020. godine za najzastupljenije skupine lijekova
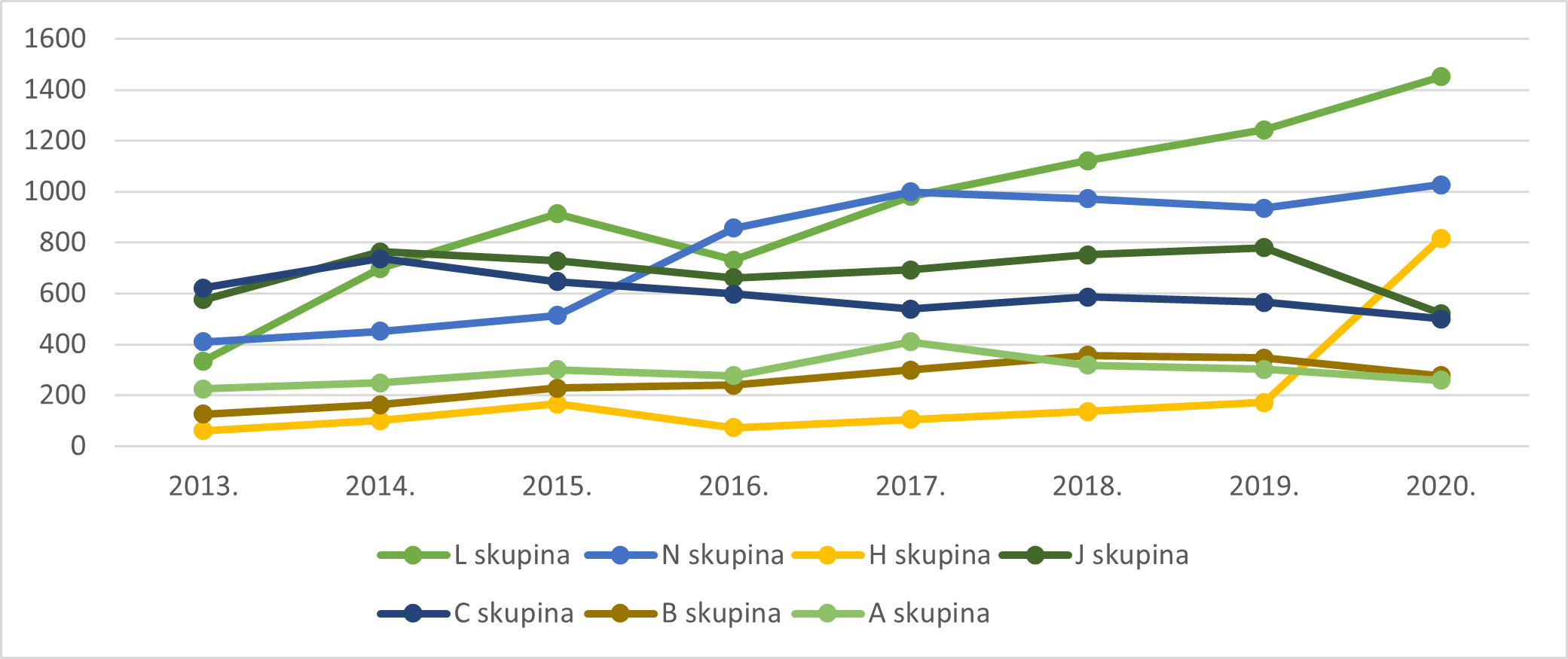
Slika 10. Kretanje broja prijava sumnji na nuspojave za pojedine skupine lijekova prema ATK klasifikaciji u razdoblju od 2013. do 2019. godine za manje zastupljene skupine lijekova
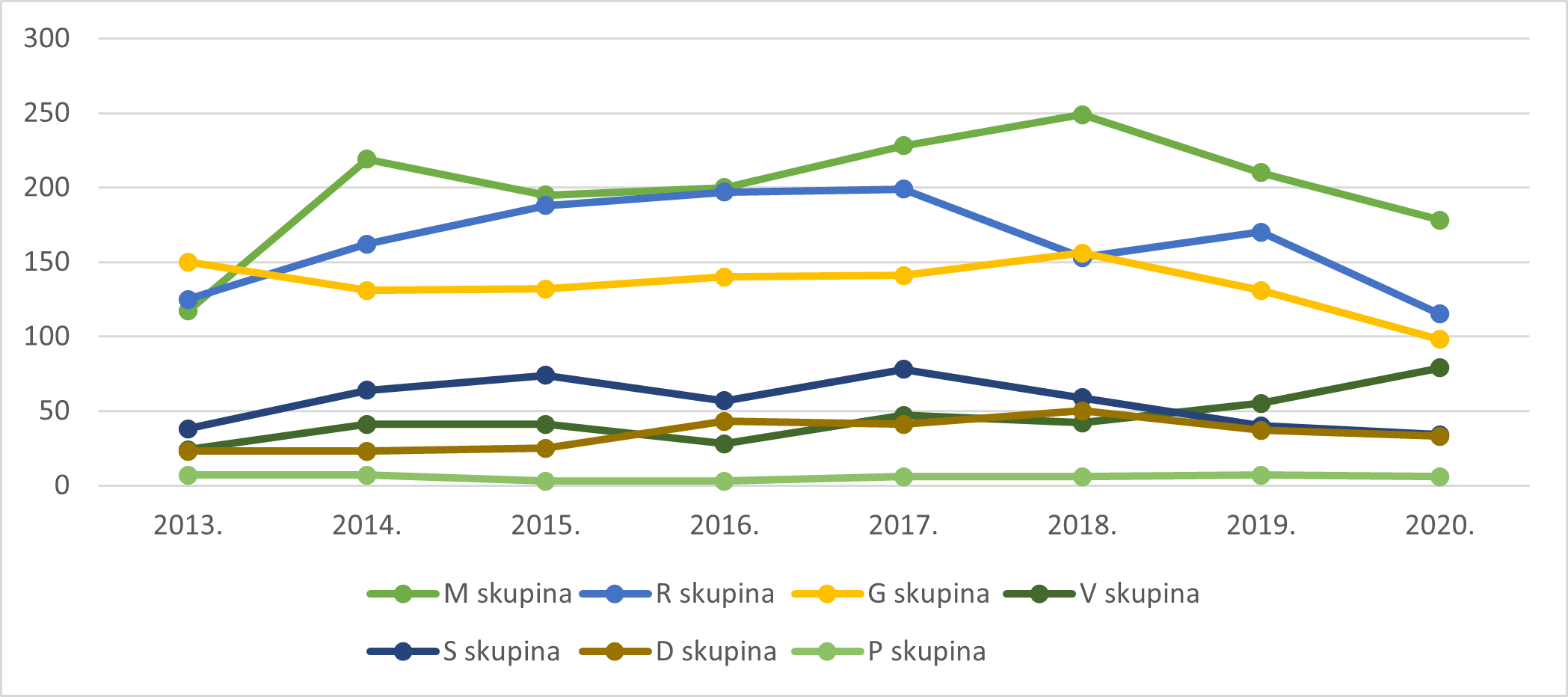
Tablica 9. Broj prijava prema ATK skupinama lijekova i prijaviteljima u 2020. godini
| Mjesto po broju prijava | Liječnici | Farmaceuti | Pacijenti/korisnici lijeka | |||
|---|---|---|---|---|---|---|
| Skupina | Broj prijava | Skupina | Broj prijava | Skupina | Broj prijava | |
| 1. | L | 1198 | H | 162 | H | 533 |
| 2. | N | 833 | C | 129 | J | 132 |
| 3. | C | 278 | J | 114 | C | 78 |
U 2020. godini liječnici su najčešće prijavljivali sumnje na nuspojave za lijekove iz ATK skupine L, jednako kao i u 2019. godini. Navedeno je moguće objasniti činjenicom da se lijekovi iz skupine L primjenjuju za liječenje zloćudnih i autoimunih bolesti, koje zahtijevaju kontinuirano praćenje bolesnika, a većina od tih lijekova primjenjuje se u bolnicama, zbog čega su pacijenti češće u kontaktu s liječnicima koji mogu primijetiti i prijaviti sumnju na nuspojavu. Farmaceuti i pacijenti/korisnici lijeka su u 2020. godini najčešće prijavljivali sumnje na nuspojave za lijekove iz ATK skupine H. Ovaj podatak razlikuje se u odnosu na prethodne godine, što je moguće objasniti povećanim prijavljivanjem sumnji na nuspojave lijeka Euthyrox početkom 2020. godine.
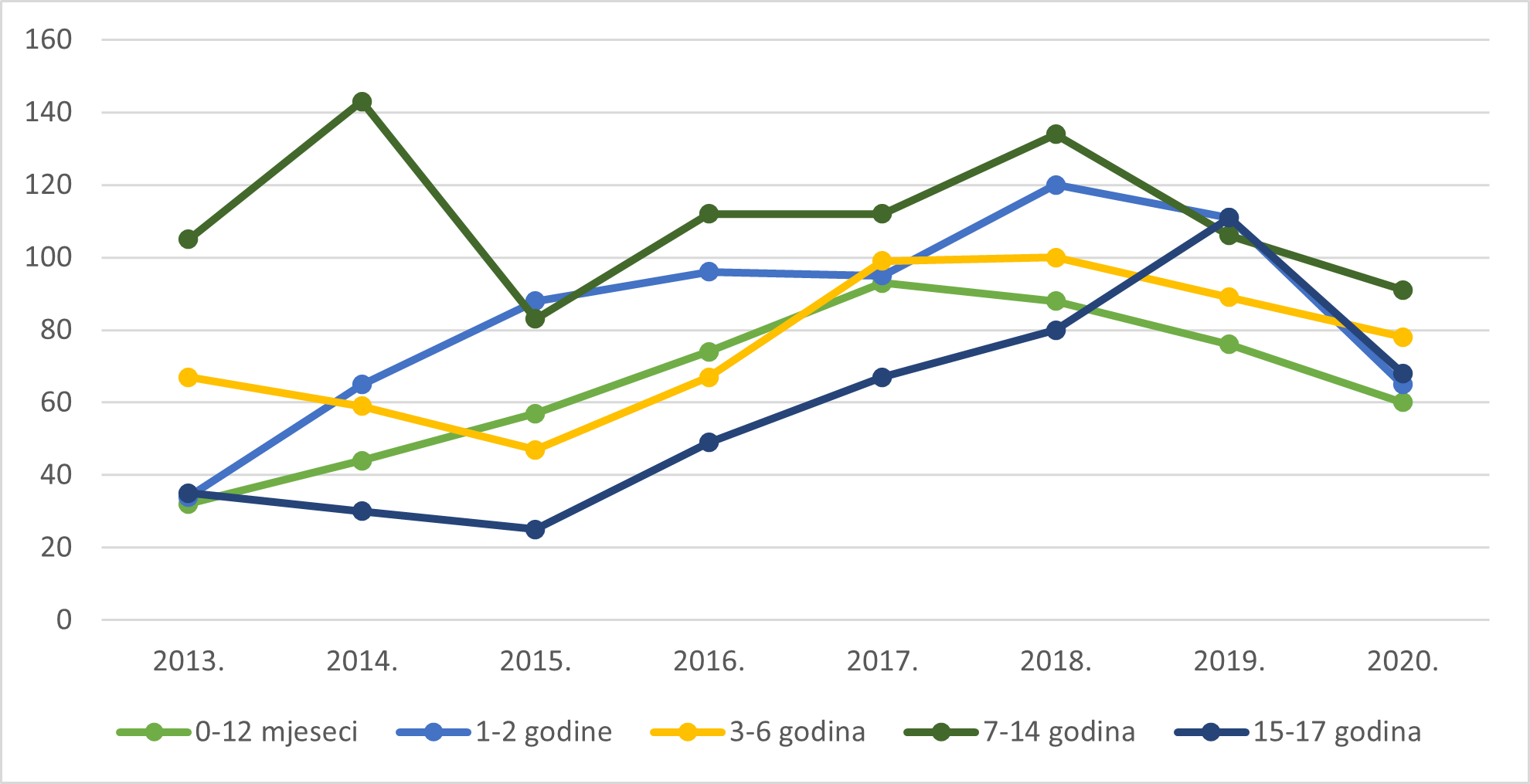
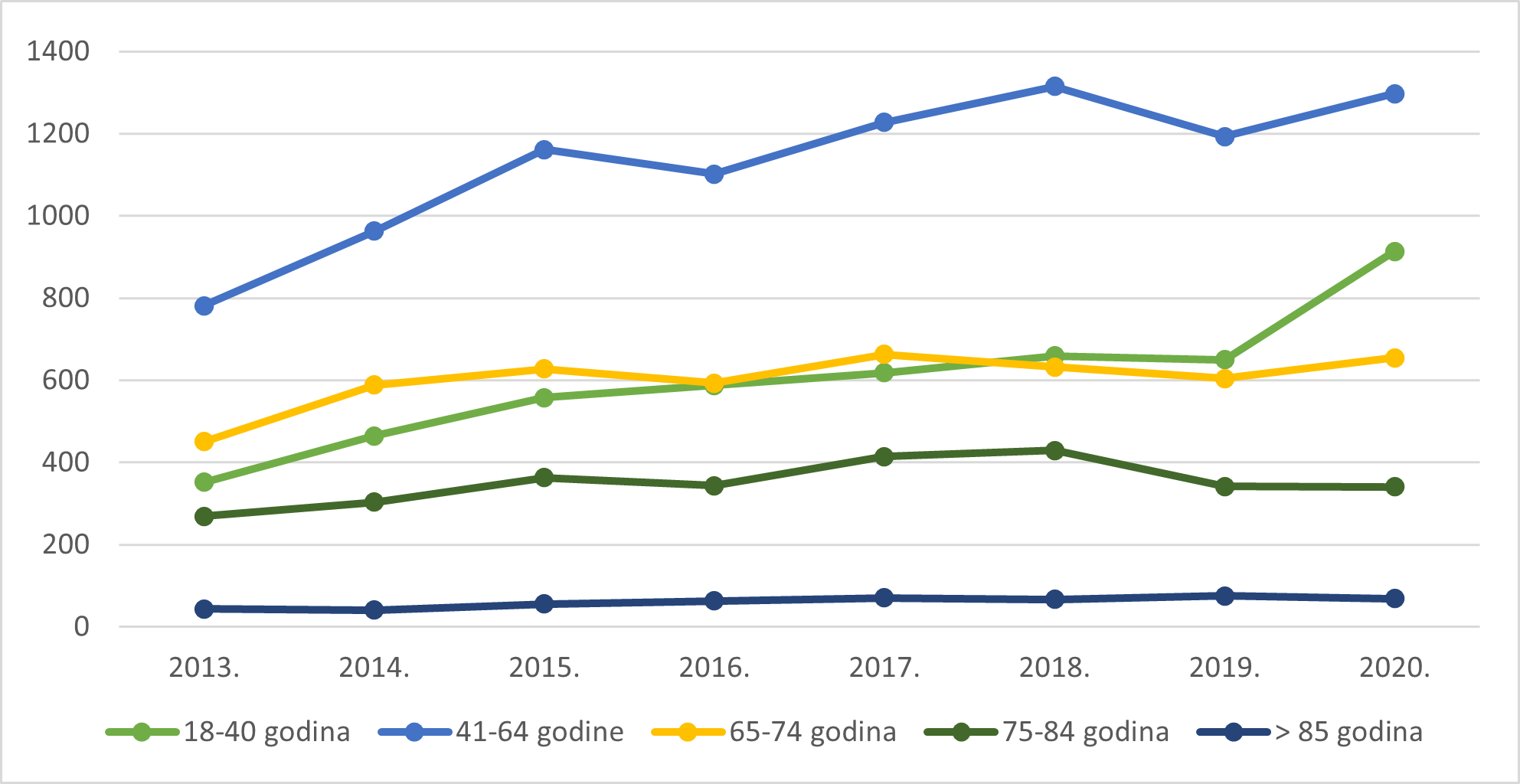
Tablica 10. prikazuje prijave sumnji na nuspojave prema dobnim skupinama bolesnika u 2020. godini u usporedbi s 2019. godinom. Udio prijava sumnji na nuspojave prema dobnim skupinama nešto je niži u pedijatrijskim dobnim skupinama do 17 godina, a nešto viši u dobnim skupinama od 18 do 74 godine u odnosu na prethodnu godinu.
Tablica 10. Pregled prijava sumnji na nuspojave prema dobnim skupinama bolesnika u 2020. godini u usporedbi s 2019. godinom
| Dobna skupina | Broj prijava u 2019. godini | Udio prijava (%) u 2019. | Broj prijava u 2020. godini | Udio prijava (%) u 2020. |
|---|---|---|---|---|
| 0 - 12 mjeseci | 76 | 1,9 | 60 | 1,5 |
| 1 do 2 godine | 111 | 2,8 | 64 | 1,6 |
| 3 do 6 godina | 89 | 2,3 | 78 | 1,9 |
| 7 do 14 godina | 106 | 2,7 | 91 | 2,3 |
| 15 do 17 godina | 111 | 2,8 | 68 | 1,7 |
| 18 do 40 godina | 650 | 16,6 | 914 | 22,7 |
| 41 do 64 godine | 1193 | 30,6 | 1297 | 32,2 |
| 65 do 74 godine | 604 | 15,5 | 653 | 16,2 |
| 75 do 84 godine | 342 | 8,8 | 341 | 8,5 |
| 85 godina i starije | 75 | 1,9 | 69 | 1,7 |
| Nepoznata dob | 547 | 14,0 | 387 | 9,6 |
| UKUPNO | 3904 | 100 | 4022 | 100 |
Slika 11. Pregled kretanja broja prijava za mlađe dobne skupine u razdoblju od 2013. do 2020. godine
Slika 12. Pregled kretanja broja prijava za osobe u dobi od 18 godina i starije u razdoblju od 2013. do 2020. godine
Tablica 11. Prijave sumnji na nuspojave prema spolu bolesnika u 2020. godini u usporedbi s 2019. godinom
| Spol | Broj prijava u 2019. godini | Broj prijava u 2020. godini | Udio prijava (%) u 2019. godini | Udio prijava (%) u 2020. godini |
|---|---|---|---|---|
| Muškarci | 1466 | 1363 | 38 | 34 |
| Žene | 2312 | 2603 | 59 | 65 |
| Nepoznato | 126 | 56 | 3 | 1 |
| UKUPNO | 3904 | 4022 | 100 | 100 |
Slika 13. Prijave sumnji na nuspojave prema spolu bolesnika u 2020. godini
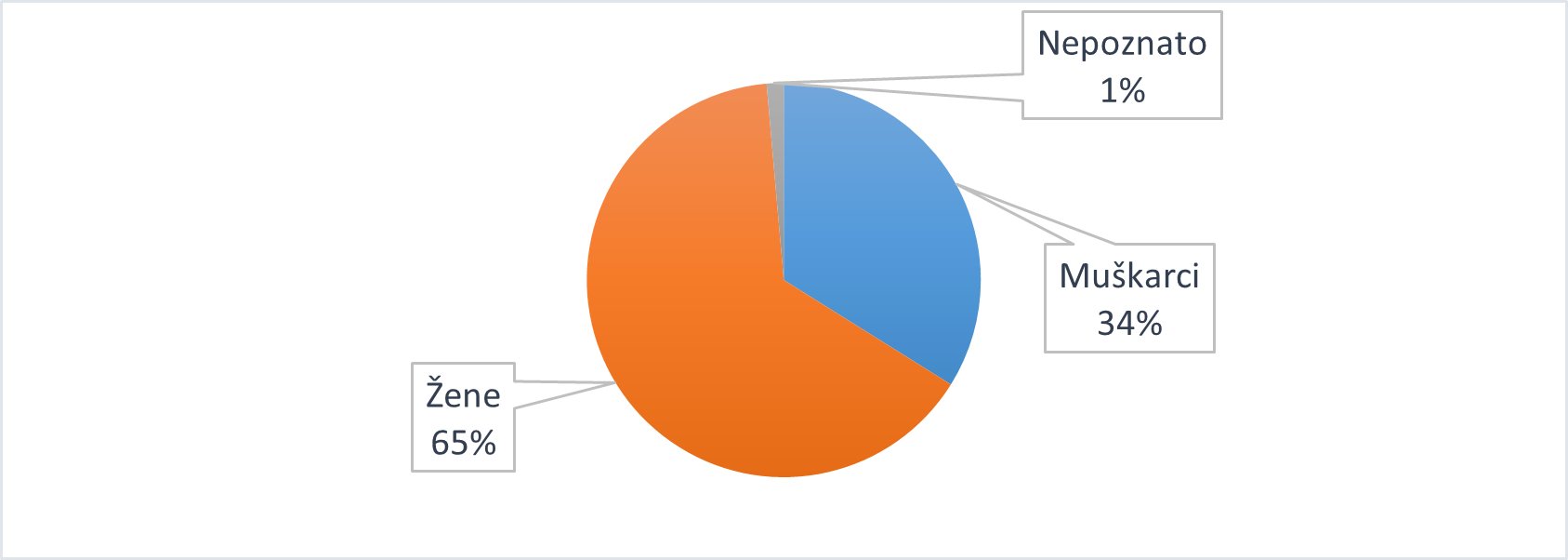
Već šesnaestu godinu zaredom veći broj prijava sumnji na nuspojave lijeka zaprimljen je za korisnice lijeka/pacijentice, odnosno osobe ženskog spola (65%). Udio prijava za osobe ženskog spola povećao se u odnosu na 2019. godinu, kada je iznosio 59%. Navedeno je moguće objasniti povećanim brojem zaprimljenih prijava sumnji na nuspojave lijeka Euthyrox zato što su bolesti štitnjače, a posljedično i korištenje nadomjesne hormonske terapije, učestalije u osoba ženskog spola.
2.2.3. Broj lijekova u istodobnoj primjeni
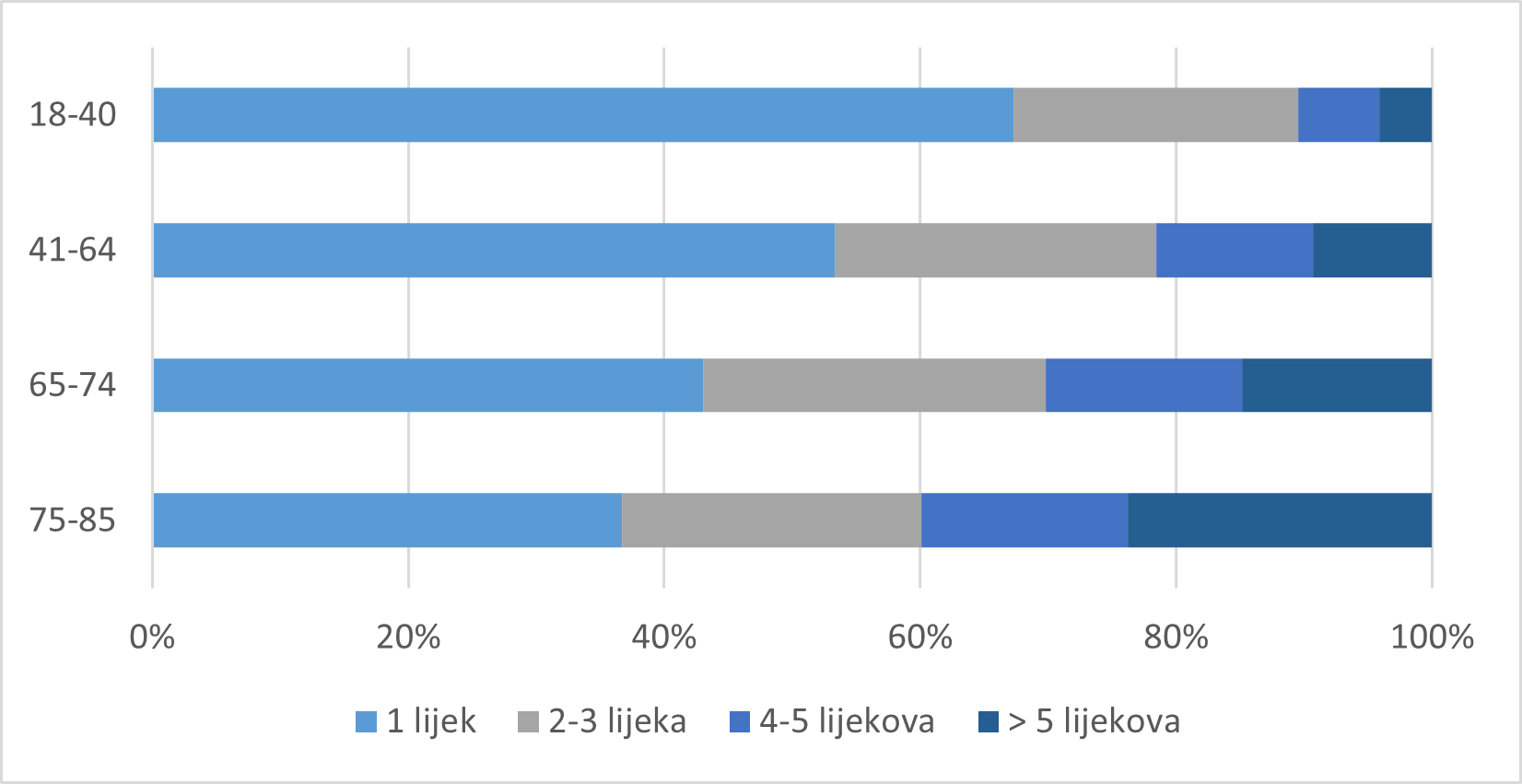
Promatrajući odnos dobi pacijenata/korisnika lijeka i broja lijekova koje istodobno primjenjuju, u 2020. godini, jednako kao i proteklih godina, u mlađih dobnih skupina prevladava primjena jednog lijeka u terapiji odnosno prevenciji bolesti. Nastavlja se trend zaprimanja prijava sumnji na nuspojave s većim brojem istodobno primijenjenih lijekova u odraslim i posebice starijim dobnim skupinama, što prikazuje Tablica 12. Navedeni podaci ukazuju na problem polifarmacije (istodobnog korištenja većeg broja lijekova) koji raste s dobi bolesnika te postaje izraženiji u starijih bolesnika, što prikazuje Slika 14. Stoga je kod starijih bolesnika potreban poseban oprez prilikom primjene većeg broja lijekova zbog mogućih interakcija lijekova, koje ujedno mogu biti i uzrok nuspojava.
Tablica 12. Broj lijekova koje pacijent/korisnik lijeka istodobno primjenjuje prema dobnim skupinama
| Dob | 1 lijek | 2-3 lijeka | 4-5 lijekova | > 5 lijekova | UKUPNO |
|---|---|---|---|---|---|
| 0-12 mjeseci | 33 | 24 | 2 | 1 | 60 |
| 1-2 godine | 53 | 9 | 2 | 0 | 64 |
| 3-6 godina | 72 | 4 | 1 | 1 | 78 |
| 7-14 godina | 62 | 21 | 5 | 3 | 91 |
| 15-17 godina | 39 | 23 | 3 | 3 | 68 |
| 18-40 godina | 615 | 203 | 58 | 38 | 914 |
| 41-64 godine | 692 | 325 | 159 | 121 | 1297 |
| 65-74 godina | 281 | 175 | 100 | 97 | 653 |
| 75-84 godina | 125 | 80 | 55 | 81 | 341 |
| > 85 godina | 27 | 12 | 13 | 17 | 69 |
| Nepoznata dob | 282 | 63 | 26 | 16 | 387 |
| UKUPNO | 2281 | 939 | 424 | 378 | 4022 |
Slika 14. Raspodjela broja prijava sumnji na nuspojave u 2020. godini prema broju lijekova u istodobnoj primjeni u dobnim skupinama za osobe u dobi od 18 godina i starije
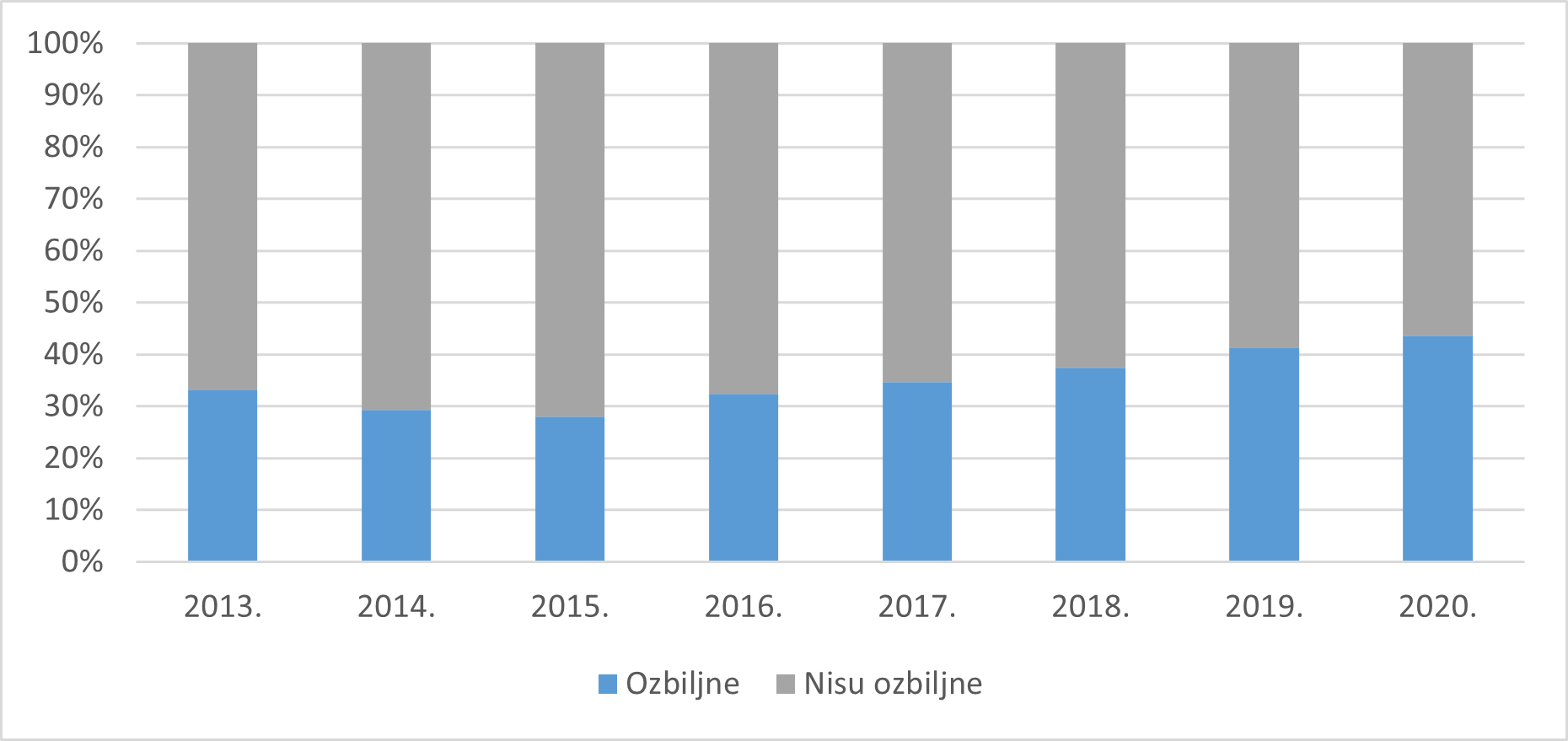
U 2020. godini zaprimljeno je 1758 prijava (44%) koje su ispunjavale najmanje jedan od kriterija prema kojima se nuspojava smatra ozbiljnom. 2264 prijave zaprimljene u 2020. godini (56%) nisu ispunjavale niti jedan od kriterija prema kojima se nuspojava smatra ozbiljnom. Udio ozbiljnih prijava (44%) niži je od udjela prijava koje nisu ozbiljne (56%). Udio ozbiljnih prijava veći je u 2020. godini u odnosu na 2019. godinu, kada je iznosio 41%.
- ako je nuspojava uzrokovala smrt osobe
- ako nuspojava ugrožava život pacijenta/korisnika lijeka
- ako je nuspojava uzrokovala potrebu za bolničkim liječenjem (hospitalizaciju) ili produljenje već postojećeg bolničkog liječenja (produljenje hospitalizacije)
- ako je nuspojava uzrokovala trajni ili teški invaliditet ili nesposobnost
- ako je došlo do razvoja prirođene anomalije ili mane od rođenja kod novorođenčeta čija je majka uzimala lijek tijekom trudnoće
- ako se radi o medicinski značajnom ozbiljnom stanju.
Ozbiljnim nuspojavama također se smatraju nuspojave navedene na Listi ozbiljnih nuspojava, odnosno IME listi (engl. Important Medical Events List) objavljenoj na internetskim stranicama HALMED-a. Ove nuspojave svrstavaju se u kategoriju medicinski značajnih ozbiljnih stanja.
Slika 15. Kretanje udjela prijava prema ozbiljnosti u razdoblju od 2013. do 2020. godine
U Tablici 13. prikazan je broj prijava ozbiljnih nuspojava prema pojedinim kriterijima ozbiljnosti prijavljenih u 2020. godini u usporedbi s 2019. godinom. Najviše prijava sumnji na nuspojave ocijenjeno je ozbiljnima prema kriteriju medicinski značajna ozbiljna stanja.
Tablica 13. Broj prijava ozbiljnih nuspojava prijavljenih u 2020. godini u usporedbi s 2019. godinom prema kriterijima ozbiljnosti
| KRITERIJ | Broj prijava u 2019. godini | Broj prijava u 2020. godini |
|---|---|---|
| Smrt | 115 | 72 |
| Ugrožava život | 102 | 118 |
| Hospitalizacija | 392 | 380 |
| Invalidnost | 17 | 23 |
| Prirođena anomalija | 1 | 1 |
| Medicinski značajno ozbiljno stanje | 1297 | 1593 |
| UKUPNO | 1924* | 2187* |
* pojedine prijave ispunjavaju više od jednog kriterija ozbiljnosti, stoga je ukupni broj u tablici veći od ukupnog broja prijava ozbiljnih nuspojava
U Tablici 14. prikazan je pregled prijava prema ozbiljnosti nuspojave i prijaviteljima u 2020. godini. U Tablici 15. prikazan je udio u ukupnom broju ozbiljnih prijava prema prijaviteljima u 2020. godini.
Tablica 14. Pregled prijava prema ozbiljnosti nuspojave i prijaviteljima u 2020. godini
| PRIJAVITELJI | Liječnici | Farmaceuti | Pacijenti/korisnici lijeka | Ostali zdravstveni radnici |
|---|---|---|---|---|
| Ukupan broj prijava iz izvora | 2168 | 708 | 948 | 198 |
| Broj i udio ozbiljnih prijava | 1248 (58%) | 132 (19%) | 253 (27%) | 125 (63%) |
| Broj i udio ne-ozbiljnih prijava | 920 (42%) | 576 (81%) | 695 (73%) | 73 (37%) |
Tablica 15. Udio u ukupnom broju ozbiljnih prijava prema prijaviteljima u 2020. godini
| PRIJAVITELJI | Liječnici | Farmaceuti | Pacijenti/korisnici lijeka | Ostali zdravstveni radnici |
|---|---|---|---|---|
| Udio u ukupnom broju ozbiljnih prijava | 71% | 8% | 14% | 7% |
Najveći udio ozbiljnih prijava u 2020. godini zaprimljen je od liječnika i iznosi 71%, što je u skladu s podacima iz 2019. godine. Od farmaceuta, pacijenata/korisnika lijeka i ostalih zdravstvenih radnika u 2020. godini zaprimljen je manji udio ozbiljnih prijava (29%), što je u skladu s podacima iz prethodnih godina. Iz navedenih podataka može se zaključiti da se pacijenti/korisnici lijeka prilikom razvoja ozbiljnih nuspojava češće obraćaju liječnicima, koji potom navedene nuspojave i prijavljuju, dok se prilikom razvoja nuspojava koje ne smatraju ozbiljnima češće obraćaju farmaceutima ili ih osobno prijavljuju.
Nuspojave se prema mehanizmu nastanka osnovno dijele na nuspojave tipa A, koje su posljedica pretjeranog farmakološkog učinka lijeka, odnosno povezane su s dozom i učestalosti primjene lijeka, i nuspojave tipa B, koje uključuju imunoalergijske reakcije, pseudoalergijske reakcije, metaboličku intoleranciju i reakcije idiosinkrazije. Sumnje na nedjelotvornost lijeka svrstavaju se u tip F nuspojava.
Tablica 16. prikazuje broj i udio prijavljenih nuspojava ovisno o tipu reakcije te ih uspoređuje s podacima iz 2019. godine.
Tablica 16. Broj i udio prijavljenih nuspojava prema tipu reakcije u 2020. godini u usporedbi s 2019. godinom
| Tip nuspojava | Broj nuspojava u 2019. godini | Broj nuspojava u 2020. godini | Udio nuspojava (%) u 2019. godini | Udio nuspojava (%) u 2020. godini |
|---|---|---|---|---|
| Tip A | 8593 | 10750 | 77,2 | 82,4 |
| Tip B | 2386 | 2110 | 21,4 | 16,2 |
| Tip F | 157 | 181 | 1,4 | 1,4 |
| UKUPNO | 11136 | 13041 | 100 | 100 |
Od 13041 nuspojave prijavljene u 2020. godini, 82,4% svrstava se u nuspojave tipa A, a 16,2% svrstava se u nuspojave tipa B. Ukupno 1,4% prijavljenih nuspojava odnosi se na sumnje na nedjelotvornost lijeka, odnosno svrstava se u nuspojave tipa F. Podaci o tipu nuspojava u 2020. godini nešto se razlikuju od podataka za 2019. godinu. Udio nuspojava tipa A u ukupnom broju nuspojava u 2020. godini veći je za 5,2%, dok je udio nuspojava tipa B u ukupnom broju nuspojava u 2020. godini manji za 5,2% u odnosu na 2019. godinu.
U Tablici 17. prikazan je broj nuspojava prema ishodu zaprimljenih u 2020. godini u usporedbi s 2019. godinom. U 2020. godini broj nuspojava bez podataka o ishodu iznosi 5766 te je veći u odnosu na 2019. godinu, kada je taj broj iznosio 4133. Veći broj prijava u kojima ishod nuspojave nije poznat bilježi se od 2016. godine, s početkom zaprimanja prijava od IMI-ja. Djelatnici IMI-ja pozive/prijave najčešće zaprimaju ili u tijeku prijevoza ili u trenutku zaprimanja bolesnika u zdravstvenu ustanovu, kada ishod nuspojave nije moguće znati. Za 3482 nuspojave kao ishod je prijavljen oporavak bez posljedica.
Sumnja da je smrtni ishod nastao kao posljedica nuspojave lijeka prijavljena je u 72 prijave. Broj prijava u kojima se sumnja da je smrtni ishod nastao kao posljedica nuspojave lijeka u 2020. godini manji je za 37,4% u odnosu na 2019. godinu. Kao i proteklih godina, u najvećem broju smrtnih slučajeva pacijenti su imali tešku podležeću bolest, primjerice zloćudnu bolest (karcinom), nasljednu metaboličku bolest, srčanu bolest ili transplantaciju organa. Prisutnost takvih bolesti otežava procjenu uzročno-posljedične povezanosti između primjene lijeka i nuspojave te je teško isključiti utjecaj tijeka progresije same bolesti na smrtni ishod.
Analizom podataka o lijekovima za koje je prijavljena sumnja na nuspojavu sa smrtnim ishodom uočava se da se, jednako kao i 2019. godine, u najvećem broju prijava radi o lijekovima iz ATK skupine L, odnosno lijekovima za liječenje zloćudnih bolesti i imunomodulatorima. Značajan broj prijava sumnji na nuspojavu sa smrtnim ishodom odnosi se na lijekove koji se nalaze pod dodatnim praćenjem, odnosno lijekove koje se prati još intenzivnije od ostalih lijekova i za koje su nositelji odobrenja obvezni pojačano prijavljivati sumnje na nuspojave u svim slučajevima. Ta obveza uključuje i sve slučajeve u kojima uzročno-posljedičnu povezanost između primjene lijeka i nuspojave nije moguće sa sigurnošću u potpunosti isključiti. Lijekovi pod dodatnim praćenjem u značajnom su dijelu inovativni lijekovi namijenjeni liječenju najtežih stanja. Stoga je još jednom važno istaknuti da prisutnost teške podležeće bolesti značajno otežava procjenu uzročno-posljedične povezanosti između primjene lijeka i nuspojave te je moguće da je u predmetnim slučajevima do smrtnog ishoda doveo prvenstveno tijek progresije same bolesti, a ne primjena lijeka.
Tablica 17. Pregled broja nuspojava prema ishodu zaprimljenih u 2020. godini u usporedbi s 2019. godinom
| Ishod nuspojave | 2019. | 2020. |
|---|---|---|
| Oporavak bez posljedica | 4050 | 3482 |
| Oporavak s posljedicama | 108 | 167 |
| Oporavak u tijeku | 1561 | 1681 |
| Nuspojava u tijeku | 1061 | 1799 |
| Nepoznato | 4133 | 5766 |
2.2.7. Nuspojave prema organskim sustavima
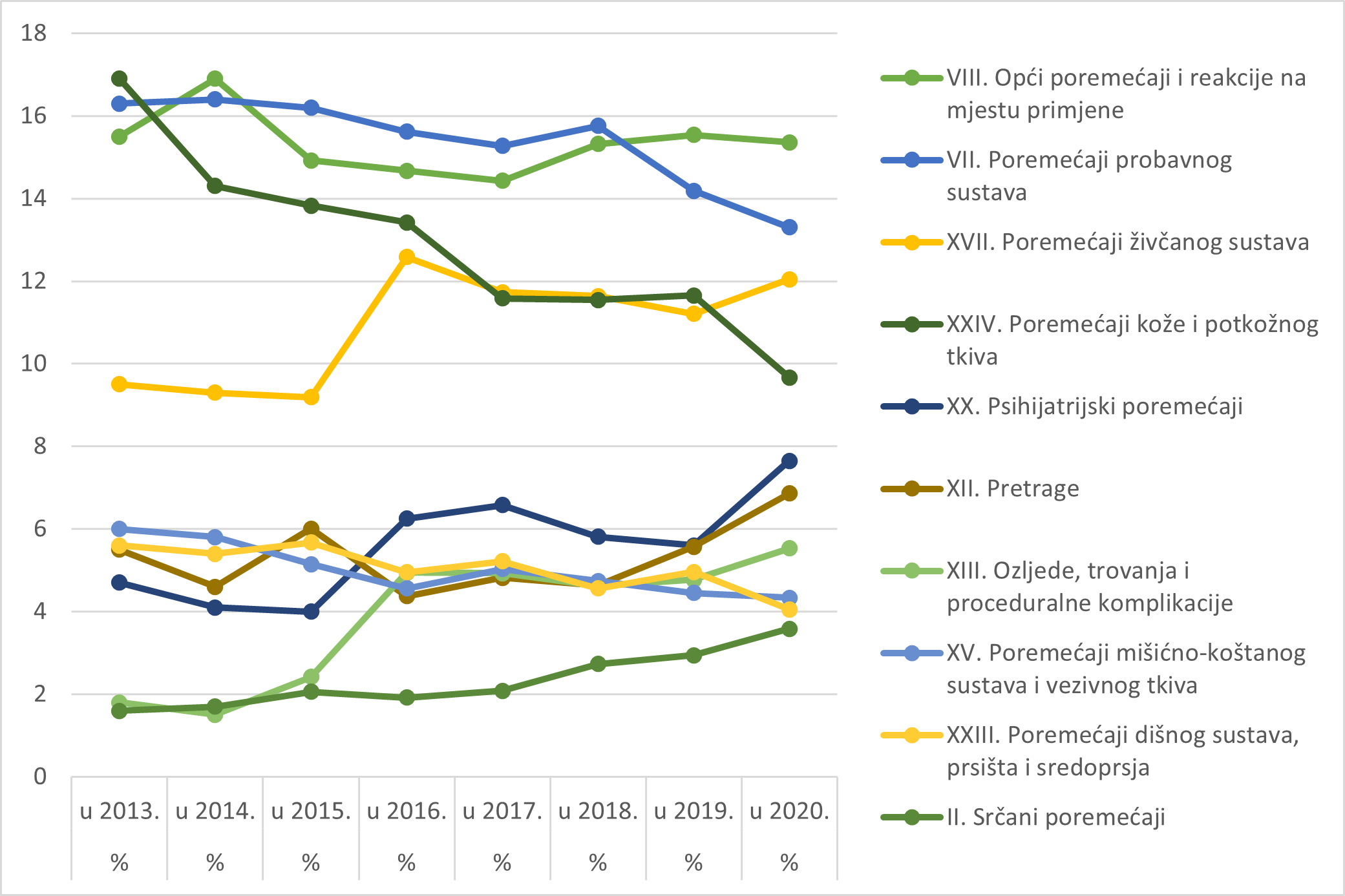
Nuspojave su navedene prema klasifikaciji organskih sustava prema MedDRA-i (MedDRA, engl. Medical Dictionary for Regulatory Activities - Medicinski rječnik za regulatorne poslove), koja se koristi u kodiranju prijavljenih nuspojava i standard je za međunarodnu komunikaciju na tom području. Najveći udio nuspojava u 2020. godini zabilježen je za organski sustav (SOC, engl. System Organ Class) Opći poremećaji i reakcije na mjestu primjene (15,36%), zatim za SOC Poremećaji probavnog sustava (13,30%) te za SOC Poremećaji živčanog sustava (12,04%).
Tablica 18. Nuspojave prema klasifikaciji organskih sustava prema MedDRA-i u 2020. godini
| Organski sustav prema MedDRA-i (SOC) | Broj nuspojava u 2020. godini | Udio nuspojava (%) u 2020. godini |
|---|---|---|
| I. Poremećaji krvi i limfnog sustava | 253 | 1,94 |
| II. Srčani poremećaji | 467 | 3,58 |
| III. Prirođeni, obiteljski i genetski poremećaji | 10 | 0,08 |
| IV. Poremećaji uha i labirinta | 130 | 1,00 |
| V. Endokrini poremećaji | 62 | 0,48 |
| VI. Poremećaji oka | 234 | 1,79 |
| VII. Poremećaji probavnog sustava | 1734 | 13,30 |
| VIII. Opći poremećaji i reakcije na mjestu primjene | 2003 | 15,36 |
| IX. Poremećaji jetre i žuči | 64 | 0,49 |
| X. Poremećaji imunološkog sustava | 120 | 0,92 |
| XI. Infekcije i infestacije | 293 | 2,25 |
| XII. Pretrage | 894 | 6,86 |
| XIII. Ozljede, trovanja i proceduralne komplikacije | 721 | 5,53 |
| XIV. Poremećaji metabolizma i prehrane | 196 | 1,50 |
| XV. Poremećaji mišićno-koštanog sustava i vezivnog tkiva | 565 | 4,33 |
| XVI. Dobroćudne, zloćudne i nespecificirane novotvorine | 196 | 1,50 |
| XVII. Poremećaji živčanog sustava | 1570 | 12,04 |
| XVIII. Stanja vezana uz trudnoću, babinje i perinatalno razdoblje | 11 | 0,08 |
| XIX. Problemi s lijekom/medicinskim proizvodom | 32 | 0,25 |
| XX. Psihijatrijski poremećaji | 998 | 7,65 |
| XXI. Poremećaji bubrega i mokraćnog sustava | 144 | 1,10 |
| XXII. Poremećaji reproduktivnog sustava i dojki | 144 | 1,10 |
| XXIII. Poremećaji dišnog sustava, prsišta i sredoprsja | 528 | 4,05 |
| XXIV. Poremećaji kože i potkožnog tkiva | 1261 | 9,67 |
| XXV. Socijalne okolnosti | 30 | 0,23 |
| XXVI. Operativni i medicinski postupci | 25 | 0,19 |
| XXVII. Krvožilni poremećaji | 356 | 2,73 |
| UKUPNO | 13041 | 100 |
Slika 16. Prikaz kretanja nuspojava iz deset najzastupljenijih organskih sustava u razdoblju od 2013. do 2020. godine
2.2.8. Najčešće prijavljene nuspojave u 2020. godini
U 2020. godini najčešće prijavljene nuspojave bile su glavobolja, mučnina, umor, somnolencija, proljev, bol u trbuhu, osip, svrbež, slabost i crvenilo, što su nuspojave karakteristične za klasične sintetske lijekove. Ovi podaci u skladu su s podacima iz prethodnih godina. Riječ je o nuspojavama koje su prijaviteljima dobro uočljive, jasno vremenski povezane s primjenom lijeka (javljaju se ubrzo nakon početka primjene lijeka, a najčešće nestaju nakon prestanka primjene lijeka) te nerijetko značajno smanjuju kvalitetu života pacijenta/korisnika lijeka, iako se regulatorno ne svrstavaju u ozbiljne nuspojave. Među najčešće prijavljenim nuspojavama nalazi se somnolencija (pretjerana pospanost), karakteristična nuspojava lijekova iz skupine N (lijekovi s djelovanjem na živčani sustav), za koje se u posljednjih nekoliko godina zaprima visoki broj prijava.
Kao posljedica prijava zaprimljenih od IMI-ja, i u 2020. godini se, jednako kao i u razdoblju od 2016. do 2019. godine, među najčešće prijavljenim reakcijama nalaze pokušaj samoubojstva i namjerno predoziranje lijekom. U navedenim slučajevima ne radi se o nuspojavama u užem smislu, odnosno nije riječ o štetnoj i neželjenoj reakciji na primjenu lijeka, već su u pitanju obrasci korištenja, odnosno načini na koje se lijek koristi, stoga ove reakcije nisu prikazane u Tablici 19. Sukladno važećim smjernicama za kodiranje nuspojava (MedDRA Points to Consider), navedeni obrasci korištenja lijeka također se kodiraju u polje za nuspojave lijeka u svrhu lakšeg praćenja i identifikacije novih sigurnosnih pitanja. U prijavama zaprimljenim od IMI-ja zabilježeno je 269 slučajeva pokušaja samoubojstva lijekom te 263 namjerna predoziranja jednim ili više lijekova.
U Tablici 19. navedene su nuspojave koje su u 2020. godini prijavljene više od 100 puta. Na Slici 17. grafički je prikazano kretanje deset najčešće prijavljenih nuspojava u 2020. godini u odnosu na razdoblje od 2013. do 2020. godine.
Nuspojave palpitacije, porast tjelesne težine, nesanica, ispadanje kose i povišeni krvni tlak proteklih se godina nisu nalazile među najčešće prijavljenim nuspojavama. U najvećem broju slučajeva ove su nuspojave prijavljene prilikom primjene lijeka Euthyrox, za koji je početkom 2020. godine zaprimljen povećan broj prijava, a čime je moguće objasniti porast u broju navedenih nuspojava.
Kao što je prethodno navedeno, početkom 2020. godine zaprimljen je povećan broj prijava sumnji na nuspojave za novu formulaciju lijeka Euthyrox. Najčešće zabilježene nuspojave za novu formulaciju lijeka odnosile su se na probavne tegobe, uključujući bolove i/ili grčeve u želucu, mučninu, dijareju, povećanje tjelesne težine, glavobolju, omaglicu, nesanicu, umor, opću slabost, osjećaj lupanja srca, aritmije, ubrzane otkucaje srca, povećan krvni tlak te pritisak, stezanje i/ili bol u prsima. Provedena je analiza prijava sumnji na nuspojave zaprimljenih za novu formulaciju lijeka te je zaključeno kako prijavljene nuspojave ne odudaraju od nuspojava zaprimljenih za staru formulaciju lijeka, odnosno iz navedenih prijava nisu identificirana nova sigurnosna pitanja. Prilikom ocjene signala odnosno ocjene potencijalno novih nuspojava vezanih uz primjenu lijeka uvijek se u obzir uzimaju klinički značaj uočene nuspojave (npr. težina nuspojave), prethodna saznanja o nuspojavi, jačina dokaza i uzročno-posljedične povezanosti, kvantitativni pokazatelji, konzistentnost podataka, odnos doze i učinka, mogući biološki mehanizam, eksperimentalni nalazi i kvaliteta podataka. Također se uvijek u obzir uzimaju mogući nesigurnosni razlozi povećanog broja prijava sumnji na nuspojave kao što su, primjerice, prvo stavljanje lijeka na tržište, odobrenje nove indikacije ili izmjena formulacije lijeka, medijska pažnja te poticanje prijavljivanja (npr. putem društvenih mreža). Ovi razlozi također su mogli pridonijeti povećanom broju zaprimljenih prijava sumnji na nuspojave za novu formulaciju lijeka.
Slika 17. Grafički prikaz kretanja 10 najčešće prijavljenih nuspojava u 2020. godini u odnosu na razdoblje od 2013. do 2020. godine
 * podaci nisu prikazani za godine u kojima se navedene nuspojave nisu nalazile među najčešće prijavljenima
* podaci nisu prikazani za godine u kojima se navedene nuspojave nisu nalazile među najčešće prijavljenima
Tablica 19. Najčešće prijavljene nuspojave u 2020. godini
| Nuspojava | Broj nuspojava u 2020. godini |
|---|---|
| Glavobolja | 339 |
| Mučnina | 327 |
| Umor | 313 |
| Somnolencija | 300 |
| Proljev | 252 |
| Bol u abdomenu | 183 |
| Osip | 176 |
| Svrbež | 173 |
| Slabost | 169 |
| Crvenilo | 166 |
| Omaglica | 161 |
| Povraćanje | 155 |
| Otežano disanje | 145 |
| Palpitacije | 144 |
| Vrućica | 122 |
| Porast tjelesne težine | 121 |
| Nesanica | 119 |
| Neučinkovitost lijeka | 114 |
| Ispadanje kose | 106 |
| Povišeni krvni tlak | 105 |
| Malaksalost | 101 |
2.3. Karakteristike posebnih skupina prijava
2.3.1. Prijave sumnji na nuspojave cjepiva
HALMED je tijekom 2020. godine zaprimio 175 prijava sumnji na nuspojave cjepiva. Broj prijava sumnji na nuspojave cjepiva u 2020. godini niži je u odnosu na 2019. godinu, kada je zaprimljeno 309 prijava. Prijave HALMED-u šalju zdravstveni radnici, pacijenti/korisnici lijeka, nositelji odobrenja za stavljanje lijeka u promet te se redovito razmjenjuju informacije o nuspojavama cjepiva s Hrvatskim zavodom za javno zdravstvo (HZJZ). Na mjesečnoj bazi održavaju se sastanci Stručne grupe za nuspojave i sigurnu primjenu cjepiva, koju čine zaposlenici HALMED-a i zaposlenici Službe za epidemiologiju zaraznih bolesti HZJZ-a.
Prijave sumnji na nuspojave cjepiva u 2020. godini najčešće su prijavljivali liječnici (109), dok se na drugom mjestu nalaze pacijenti, roditelji pacijenta ili drugi članovi obitelji pacijenta (50). Manji broj sumnji na nuspojave cjepiva prijavili su farmaceuti (13) i ostali zdravstveni radnici (3).
Udio prijava koje ispunjavaju najmanje jedan od kriterija prema kojima se klasificiraju kao ozbiljne iznosi 43%, dok udio prijava koje ne ispunjavaju niti jedan od tih kriterija iznosi 57%. Prilikom ocjene ozbiljnosti prijava sumnji na nuspojave cjepiva primjenjuju se isti kriteriji kao i kod nuspojava lijekova, navedeni u dijelu 2.2.4. Izvješća.
Najčešće prijavljene nuspojave cjepiva u 2020. godini bile su vrućica i povišena tjelesna temperatura, reakcije na mjestu primjene cjepiva poput otekline, boli i crvenila, osip i glavobolja. Podaci o najčešće prijavljenim nuspojavama cjepiva prikazani su u Tablici 20. Navedene nuspojave očekivane su prilikom primjene cjepiva, obično su blažeg karaktera te prolaze kroz nekoliko dana bez potrebe za dodatnim liječenjem ili uz simptomatsko liječenje (primjerice analgeticima i antipireticima i/ili primjenom hladnih obloga).
Tablica 20. Najčešće prijavljene nuspojave cjepiva u 2020. godini
| Nuspojava | Broj prijava u 2020. godini |
|---|---|
| Vrućica i povišena tjelesna temperatura | 67 |
| Oteklina na mjestu primjene | 41 |
| Bol na mjestu primjene | 25 |
| Crvenilo na mjestu primjene | 24 |
| Osip | 19 |
| Glavobolja | 19 |
| Plač | 18 |
| Malaksalost | 16 |
| Umor | 14 |
| Zimica | 11 |
| Crvenilo | 11 |
| Bolovi u mišićima | 11 |
2.3.2. Prijave zaprimljene od Centra za kontrolu otrovanja Instituta za medicinska istraživanja i medicinu rada
Tijekom 2020. godine nastavljena je suradnja s Centrom za kontrolu otrovanja Instituta za medicinska istraživanja i medicinu rada (IMI) u sklopu koje IMI prosljeđuje prijave otrovanja lijekovima HALMED-u. U 2020. godini IMI je HALMED-u proslijedio 856 prijava otrovanja odnosno predoziranja jednim ili više lijekova.
Od navedenog broja, 403 prijave sadržavale su podatak o nuspojavi lijeka. Te su prijave obrađene i prikazane u Izvješću kao dio ukupnog broja prijava sumnji na nuspojave zaprimljenih u 2020. godini.
Preostale 453 prijave nisu sadržavale podatak o nuspojavi ili je u njima bilo jasno navedeno da nije došlo do nuspojave. Ove prijave nisu uključene u obradu kao dio ukupnog broja prijava sumnji na nuspojave zaprimljenih u 2020. godini, ali su prikazane u ovom dijelu Izvješća. U sklopu farmakovigilancijskih aktivnosti HALMED takve prijave također evidentira i ocjenjuje te prosljeđuje nositeljima odobrenja za stavljanje lijeka u promet, uzimajući u obzir da one predstavljaju važan izvor podataka u praćenju cjelokupnog sigurnosnog profila lijeka. Takve prijave najčešće sadrže podatke o primjeni lijeka izvan uvjeta odobrenja za stavljanje lijeka u promet, pogrešnoj uporabi lijeka, zlouporabi lijeka, predoziranju, medikacijskim pogreškama i profesionalnoj izloženosti lijeku.
U ovom dijelu su prikazane i obrađene sve prijave zaprimljene od IMI-ja, neovisno o tome sadrže li podatak o nuspojavi lijeka.
Tablica 21. Broj prijava zaprimljenih od IMI-ja u 2020. godini
| Ukupan broj prijava IMI-ja | Broj prijava koje sadrže podatak o nuspojavi lijeka | Broj prijava koje ne sadrže podatak o nuspojavi lijeka |
|---|---|---|
| 856 | 403 | 453 |
Slika 18. Pregled prijava proslijeđenih od IMI-ja prema skupinama prijavitelja u 2020. godini
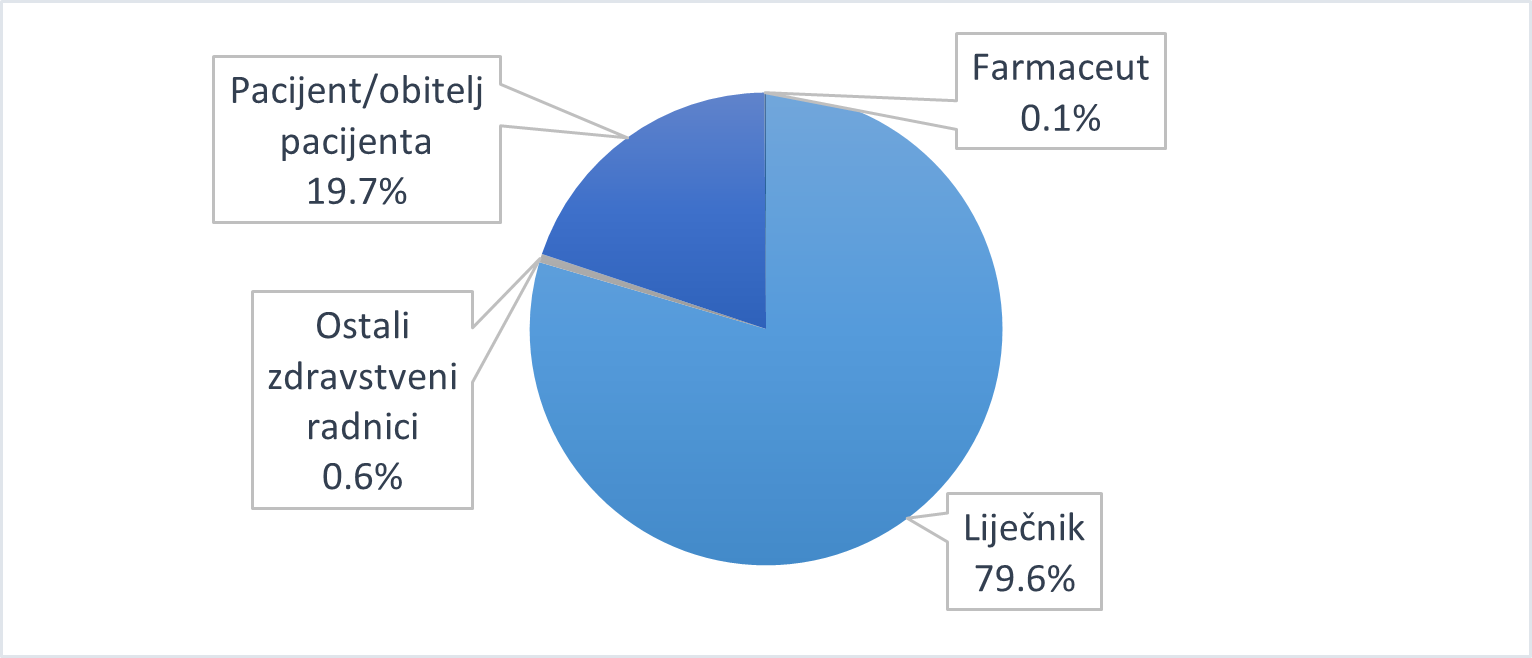
Analizom prijava proslijeđenih od IMI-ja prema skupinama prijavitelja uočava se da je više od tri četvrtine (79,6%) prijava zaprimljeno od liječnika (Slika 18.). Navedeni podatak je očekivan s obzirom na to da IMI pruža stručne informacije liječnicima te savjetuje o postupcima liječenja otrovanja lijekovima. Rana konzultacija s Centrom za kontrolu otrovanja IMI-ja omogućuje racionalnije korištenje zdravstvenih usluga i sprječava nepotrebne medicinske postupke koji mogu biti neugodni ili u pojedinim slučajevima rizični za pacijenta. Dio prijava (19,7%) zaprimljen je od pacijenata/obitelji pacijenata koji su se izravno obratili IMI-ju tražeći savjet o postupcima koje je potrebno poduzeti te su se većinom odnosili na slučajnu izloženost lijeku.
Slika 19. Pregled prijava proslijeđenih od IMI-ja prema spolu bolesnika u 2020. godini
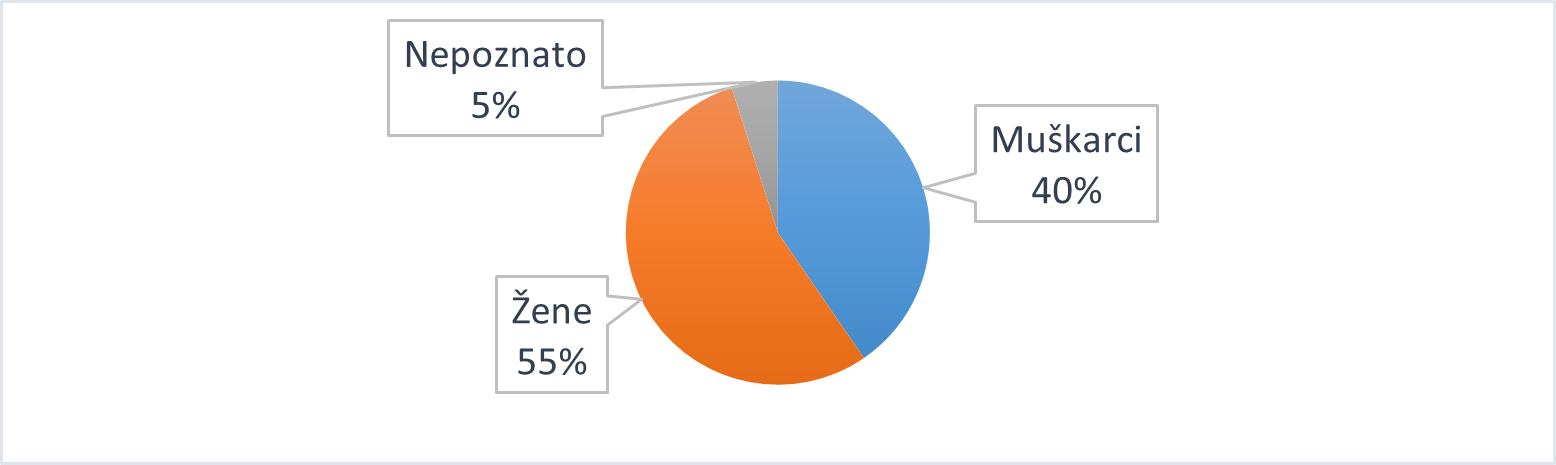
Kada se prijave zaprimljene od IMI-ja promatraju prema spolu bolesnika, uočava se da je za bolesnike muškog spola zaprimljeno 40% prijava, što je nešto više u odnosu na udio u ukupnom broju prijava sumnji na nuspojave u 2020. godini (34%). Udio prijava koji se odnosi na ženski spol niži je (55%) u odnosu na udio u ukupnom broju prijava sumnji na nuspojave u 2020. godini (65%) (Slika 19.).
Tablica 22. Broj i udio prijava zaprimljenih od IMI-ja prema dobnim skupinama bolesnika u usporedbi s ukupnim brojem i udjelom prijava sumnji na nuspojave lijekova u 2020. godini
| Dob bolesnika | Prijave IMI-ja u 2020. | Udio prijava IMI-ja (%) u 2020. | Prijave u 2020. | Udio prijava (%) u 2020. |
|---|---|---|---|---|
| 0 do 12 mjeseci | 51 | 6,0 | 60 | 1,5 |
| 1 do 2 godine | 152 | 17,8 | 64 | 1,6 |
| 3 do 6 godina | 118 | 13,8 | 78 | 1,9 |
| 7 do 14 godina | 64 | 7,5 | 91 | 2,3 |
| 15 do 17 godina | 77 | 9,0 | 68 | 1,7 |
| 18 do 40 godina | 162 | 18,9 | 914 | 22,7 |
| 41 do 64 godine | 156 | 18,2 | 1297 | 32,2 |
| 65 do 74 godine | 32 | 3,7 | 653 | 16,2 |
| 75 do 84 godine | 12 | 1,4 | 341 | 8,5 |
| 85 godina i starije | 7 | 0,8 | 69 | 1,7 |
| Nepoznata dob | 25 | 2,9 | 387 | 9,6 |
| UKUPNO | 856 | 100 | 4022 | 100 |
Tablica 22. prikazuje broj i udio prijava zaprimljenih od IMI-ja u usporedbi s ukupnim brojem i udjelom prijava sumnji na nuspojave lijekova u 2020. godini prema dobnim skupinama bolesnika. Kao i prethodnih godina, značajno veći udio prijava zaprimljenih od IMI-ja odnosi se na mlađe dobne skupine. Za pedijatrijsku skupinu bolesnika (bolesnici mlađi od 18 godina) zaprimljeno je 54% prijava IMI-ja, dok je u ukupnom broju prijava sumnji na nuspojave u 2020. godini za navedenu dobnu skupinu zaprimljeno 9% prijava. Značajni dio navedenih prijava u dobnim skupinama do sedam godina odnosi se na slučajnu izloženost lijeku, primjerice slučajeve kada je dijete slučajno progutalo lijek, što najčešće nije rezultiralo nuspojavom. Ako je u takvim slučajevima došlo do nuspojava, većinom nisu bile ozbiljne. U dobnoj skupini od 7 do14 godina, a osobito u dobnoj skupini od 15 do17 godina veći je broj ozbiljnih prijava, koje se većinom odnose na pokušaj samoubojstva namjernim predoziranjem jednim ili više lijekova.
U prijavama zaprimljenima od IMI-ja zabilježeno je ukupno 1359 lijekova pod sumnjom. Kada se lijekovi promatraju prema anatomsko-terapijsko-kemijskoj (ATK) klasifikaciji, vidljivo je da najveći broj lijekova za koje su zabilježene prijave pripada skupini N (lijekovi s djelovanjem na živčani sustav) i iznosi 56,4%. Ostale skupine lijekova znatno su manje zastupljene; na drugom mjestu nalazi se skupina C (lijekovi s djelovanjem na kardiovaskularni sustav) s 10,8% lijekova, a na trećem mjestu nalazi se skupina M (lijekovi s djelovanjem na koštano-mišićni sustav) s 8,2% lijekova. Podaci su u skladu s podacima iz prethodnih godina, od kada se zaprimaju prijave od IMI-ja.
Tablica 23. Pregled lijekova prema ATK klasifikaciji za prijave zaprimljene od IMI-ja u 2020. godini
| ATK klasifikacija | 2020. | Udio (%) u IMI prijavama |
|---|---|---|
| ATK 1. razina A skupina (probavni sustav) | 84 | 6,2 |
| ATK 1. razina B skupina (učinak na krv) | 27 | 2,0 |
| ATK 1. razina C skupina (kardiovaskularni sustav) | 147 | 10,8 |
| ATK 1. razina D skupina (dermatici) | 32 | 2,4 |
| ATK 1. razina G skupina (urogenitalni sustav i spolni hormoni) | 15 | 1,1 |
| ATK 1. razina H skupina (sustavni hormonski lijekovi) | 30 | 2,2 |
| ATK 1. razina J skupina (liječenje sustavnih infekcija) | 40 | 2,9 |
| ATK 1. razina L skupina (citostatici) | 5 | 0,4 |
| ATK 1. razina M skupina (koštano-mišićni sustav) | 111 | 8,2 |
| ATK 1. razina N skupina (živčani sustav) | 767 | 56,4 |
| ATK 1. razina P skupina (parazitne infekcije) | 4 | 0,3 |
| ATK 1. razina R skupina (respiratorni sustav) | 71 | 5,2 |
| ATK 1. razina S skupina (pripravci za osjetila) | 10 | 0,7 |
| ATK 1. razina V skupina (različito) | 16 | 1,2 |
| UKUPAN BROJ LIJEKOVA | 1359 | 100 |
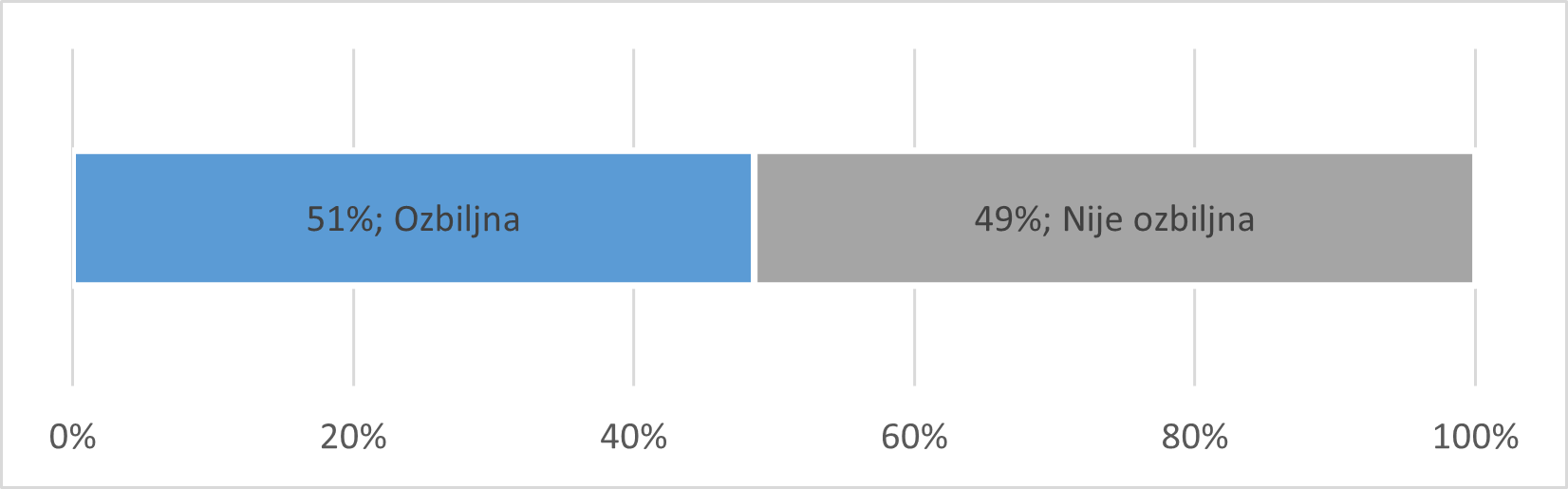
Broj prijava koje ne ispunjavaju niti jedan od kriterija prema kojima se prijava smatra ozbiljnom iznosi 440 (51%), dok broj prijava koje ispunjavaju najmanje jedan od tih kriterija iznosi 416 (49%). Udio ozbiljnih prijava zaprimljenih od IMI-ja veći je u odnosu na udio u ukupnom broju prijava sumnji na nuspojave u 2020. godini (44%). Veći udio ozbiljnih prijava od IMI-ja može se objasniti činjenicom da se svaki pokušaj samoubojstva namjernim predoziranjem jednim ili više lijekova smatra ozbiljnom prijavom, neovisno o tome je li rezultirao nuspojavom. Udio prijava prema ozbiljnosti prikazan je na Slici 20.
Slika 20. Prijave zaprimljene od IMI-ja u 2020. godini prikazane prema ozbiljnosti
U prijavama zaprimljenima od IMI-ja u 2020. godini zabilježene su ukupno 2324 različite reakcije. Tablica 24. prikazuje u kojim je organskim sustavima sukladno MedDRA klasifikaciji organskih sustava (SOC) zabilježeno najviše reakcija. Na prvom mjestu nalazi se SOC Ozljede, trovanja i proceduralne komplikacije, za koji je zabilježeno 37,4% reakcija. Navedeni udio je očekivan s obzirom na to da se radi o prijavama otrovanja jednim ili više lijekova. Na drugom mjestu nalazi se SOC Psihijatrijski poremećaji s 19,4% reakcija, dok je na trećem mjestu SOC Opći poremećaji i reakcije na mjestu primjene s 16,9% reakcija.
Tablica 24. Pregled reakcija prema klasifikaciji organskih sustava prema MedDRA-i za prijave od IMI-ja u 2020. godini
| Organski sustav prema MedDRA-i (SOC) | Broj reakcija | Udio reakcija (%) u prijavama IMI-ja |
|---|---|---|
| I. Poremećaji krvi i limfnog sustava | 2 | 0,1 |
| II. Srčani poremećaji | 41 | 1,8 |
| III. Prirođeni, obiteljski i genetski poremećaji | 0 | 0 |
| IV. Poremećaji uha i labirinta | 2 | 0,1 |
| V. Endokrini poremećaji | 0 | 0 |
| VI. Poremećaji oka | 24 | 1,0 |
| VII. Poremećaji probavnog sustava | 81 | 3,5 |
| VIII. Opći poremećaji i reakcije na mjestu primjene | 392 | 16,9 |
| IX. Poremećaji jetre i žuči | 0 | 0 |
| X. Poremećaji imunološkog sustava | 0 | 0 |
| XI. Infekcije i infestacije | 0 | 0 |
| XII. Pretrage | 45 | 1,9 |
| XIII. Ozljede, trovanja i proceduralne komplikacije | 869 | 37,4 |
| XIV. Poremećaji metabolizma i prehrane | 10 | 0,4 |
| XV. Poremećaji mišićno-koštanog sustava i vezivnog tkiva | 9 | 0,4 |
| XVI. Dobroćudne, zloćudne i nespecificirane novotvorine | 0 | 0 |
| XVII. Poremećaji živčanog sustava | 336 | 14,5 |
| XVIII. Stanja vezana uz trudnoću, babinje i perinatalno razdoblje | 0 | 0 |
| XIX. Problemi s lijekom/medicinskim proizvodom | 0 | 0 |
| XX. Psihijatrijski poremećaji | 452 | 19,4 |
| XXI. Poremećaji bubrega i mokraćnog sustava | 5 | 0,3 |
| XXII. Poremećaji reproduktivnog sustava i dojki | 0 | 0 |
| XXIII. Poremećaji dišnog sustava, prsišta i sredoprsja | 10 | 0,4 |
| XXIV. Poremećaji kože i potkožnog tkiva | 2 | 0,1 |
| XXV. Socijalne okolnosti | 0 | 0 |
| XXVI. Operativni i medicinski postupci | 2 | 0,1 |
| XXVII. Krvožilni poremećaji | 41 | 1,8 |
| UKUPNO | 2324 | 100 |
Pregledom prijava zaprimljenih od IMI-ja prema tipu nuspojave (opisano u dijelu 2.2.5.), 98% reakcija ubraja se u tip A, a 2% u reakcije tipa B. Navedena raspodjela reakcija istovjetna je raspodjeli u posljednje tri godine te je očekivana s obzirom na to da se radi o prijavama otrovanja i predoziranja jednim ili više lijekova, u kojima su izraženi prekomjerni farmakološki učinci lijekova.
3. Pregled sigurnosnih pitanja u 2020. godini
3.1. Pregled najvažnijih sigurnosnih regulatornih mjera poduzetih u 2020. godini
3.1.1. Započela nova ocjena lijekova s djelatnom tvari ulipristalacetat zbog rizika od oštećenja jetre i preporučeno ograničenje primjene lijekova s djelatnom tvari ulipristalacetat
Europska agencija za lijekove (EMA) je u 2018. godini ocijenila da postoji rizik za pojavu rijetkog, ali ozbiljnog oštećenja funkcije jetre prilikom primjene lijekova koji sadrže ulipristalacetat za liječenje fibroida maternice. Stoga su uvedene dodatne mjere minimizacije rizika koje su uključivale ograničenje primjene i izdavanje preporuka za provođenje redovitih pretraga funkcije jetre prije, tijekom i nakon liječenja. Povjerenstvo za ocjenu rizika na području farmakovigilancije (PRAC) pri EMA-i započelo je u 2020. godini novu ocjenu navedenog rizika, temeljem dodatnog slučaja oštećenja funkcije jetre koji je doveo do transplantacije jetre te je preporučilo prestanak uzimanja lijekova koji sadrže ulipristalacetat u jačini od 5 mg u liječenju fibroida maternice tijekom ocjene.
Zbog navedenog sigurnosnog pitanja upućeno je pismo zdravstvenim radnicima, a javnost je obaviještena putem internetskih stranica HALMED-a. Preporučeno je sljedeće:
- Liječenje ulipristalacetatom jačine 5 mg ne smije se započinjati u novih bolesnica te se mora prekinuti kod bolesnica na terapiji ulipristalacetatom jačine 5 mg.
- Testove jetrene funkcije potrebno je provesti unutar dva do četiri tjedna nakon prestanka liječenja ulipristalacetatom.
- Bolesnicama treba savjetovati da odmah prijave znakove ili simptome koji odgovaraju oštećenju funkcije jetre (kao što su mučnina, povraćanje, bol u desnom gornjem dijelu abdomena, anoreksija, astenija, žutica), a koji se mogu pojaviti nakon prestanka liječenja ulipristalacetatom.
Lijekovi s djelatnom tvari ulipristalacetat bili su odobreni za liječenje umjerenih do ozbiljnih simptoma fibroida maternice, nekanceroznih (benignih) tumora maternice, u žena koje još nisu u menopauzi. Primjenjivali su se do tri mjeseca prije operacije kojom se uklanjaju fibroidi, a ovaj tromjesečni ciklus mogao se ponavljati, s pauzama između dva ciklusa.
U Europskoj uniji centraliziranim postupkom s djelatnom tvari ulipristalacetat odobren je lijek Esmya, koji je bio predmet ocjene i u 2018. godini, te lijek Ulipristal Acetate Gedeon Richter. U nekoliko zemalja EU-a nacionalnim postupcima su pod različitim zaštićenim imenima odobreni generički lijekovi koji sadrže djelatnu tvar ulipristalacetat.
Ulipristilacetat je također djelatna tvar lijeka za hitnu kontracepciju u jednokratnoj primjeni, ellaOne. Međutim, ovaj lijek nije bio obuhvaćen ovom ocjenom jer nije bilo zaprimljenih prijava ozbiljnog oštećenja jetre prilikom primjene navedenog lijeka.
PRAC je u svojoj ocjeni razmotrio sve dostupne podatke, uključujući prijavljene slučajeve ozbiljnih oštećenja jetre, te konzultirao predstavnike pacijenata i zdravstvenih radnika, uključujući specijaliste ginekologije. PRAC je potvrdio da lijekovi koji sadrže ulipristalacetat u dozi od 5 mg, koji se koriste za liječenje simptoma fibroida maternice, mogu uzrokovati oštećenje jetre, uključujući potrebu za transplantacijom jetre. Budući da nije bilo moguće utvrditi koji su pacijenti najizloženiji riziku ili odrediti mjere koje bi mogle umanjiti rizik, PRAC je zaključio da rizici nadmašuju koristi primjene ovih lijekova te preporučio ukidanje odobrenja za stavljanje u promet navedenih lijekova.
Preporuke PRAC-a proslijeđene su Povjerenstvu za humane lijekove (engl. Committee for Medicinal Products for Human Use, CHMP), koje je preporučilo ograničenje primjene lijekova koji sadrže ulipristalacetat jačine 5 mg. Ti se lijekovi sada smiju koristiti isključivo za liječenje fibroida maternice u žena u premenopauzi kod kojih kirurški zahvati (uključujući embolizaciju) nisu prikladni ili nisu imali učinak, a ne smiju se koristiti za kontrolu simptoma fibroida maternice dok se čeka kirurško liječenje.
Zbog restrikcije indikacije upućeno je pismo zdravstvenim radnicima, a javnost je obaviještena putem internetskih stranica HALMED-a.
3.1.2. Preporučeno ograničenje primjene lijekova koji sadrže ciproteron zbog rizika od razvoja meningeoma
Ciproteron je lijek koji inhibira djelovanje androgena, spolnih hormona prisutnih u žena i muškaraca koji djeluju na isti način kao spolni hormon progesteron. Lijekovi koji sadrže ciproteron primjenjuju se za liječenje stanja ovisnih o androgenima, poput hirzutizma (prekomjerni rast dlaka), alopecije (gubitak dlaka na vlasištu i/ili drugim dijelovima tijela), akni, karcinoma prostate te za smanjenje nagona kod seksualnih devijacija u muškaraca. Koriste se kao kontracepcija te u hormonskoj nadomjesnoj terapiji. Ciproteronski lijekovi sadrže ili samo ciproteron ili kombinaciju nižih doza ciproterona s estrogenima (treća vrsta spolnih hormona).
U Republici Hrvatskoj odobreni su sljedeći lijekovi koji sadrže ciproteron:
- Androcur 50 mg tablete (sadrži 50 mg ciproteron acetata)
- Axira 35 filmom obložene tablete (sadrži 2 mg ciproteron acetata i 0,035 mg etinilestradiola)
- Bellune 35 obložene tablete (sadrži 2 mg ciproteron acetata i 0,035 mg etinilestradiola)
- Diane-35 obložene tablete (sadrži 2 mg ciproteron acetata i 0,035 mg etinilestradiola)
PRAC je preporučio da se lijekovi s 10 mg i više ciproterona dnevno trebaju primjenjivati za stanja ovisna o androgenima, poput hirzutizma (prekomjerni rast dlaka), alopecije (gubitak dlaka na vlasištu i/ili drugim dijelovima tijela), akni i seboreje (prekomjerno lučenje loja), jedino ako druge mogućnosti liječenja, uključujući liječenje nižim dozama, nisu bile uspješne ili nisu primjenjive. Nakon postizanja učinka višim dozama lijeka, doziranje se treba postupno smanjivati do najniže djelotvorne doze lijeka. PRAC je preporučio primjenu navedenih lijekova kod seksualnih devijacija u muškaraca jedino kada druge mogućnosti nisu prikladne. Primjena lijekova kod liječenja karcinoma prostate ostala je nepromijenjena.
Ove preporuke donesene su temeljem ocjene rizika od razvoja rijetkog tumora meningeoma uz primjenu lijekova koji sadrže ciproteron. Meningeom je tumor moždane ovojnice i ovojnice leđne moždine, koji najčešće nije maligan i ne pripada u karcinome, no može uzrokovati ozbiljne komplikacije zbog položaja u/i oko mozga i leđne moždine. Ova je nuspojava rijetka, tj. može se javiti u 1 do 10 slučajeva na 10 000 bolesnika, ovisno o primijenjenoj dozi i trajanju liječenja, a rizik je veći kod viših kumulativnih doza lijeka (pri većoj ukupnoj količini lijeka koju je osoba primijenila kroz vrijeme liječenja).
Dostupni podaci upućuju na to da nema rizika kod primjene lijekova s niskom dozom ciproterona (1-2 mg) u kombinaciji s etinilestradiolom ili estradiol valeratom, koji se primjenjuju u liječenju akni, hirzutizma, kao kontracepcija ili nadomjesna hormonska terapija. Međutim, kao mjera opreza, navedeni lijekovi se ne smiju primjenjivati u ljudi koji imaju ili su imali meningeom. Navedena kontraindikacija već postoji kod lijekova s višim dozama ciproterona.
Liječnici trebaju pratiti pojavu simptoma meningeoma u bolesnika, poput promjena vida, gubitka sluha ili zujanja u ušima, gubitka osjeta mirisa, glavobolje, slabijeg pamćenja, napadaja ili slabosti u rukama i nogama. Ako je bolesniku dijagnosticiran meningeom, lijekovi koji sadrže ciproteron moraju se trajno prestati uzimati.
Zbog navedenog sigurnosnog pitanja upućeno je pismo zdravstvenim radnicima, a javnost je obaviještena putem internetskih stranica HALMED-a.
3.1.3. Započela ocjena određenih lijekova za liječenje karcinoma koji sadrže djelatnu tvar ifosfamid te je zaključeno da koristi primjene nadmašuju rizike
PRAC je u 2020. godini započeo ocjenu određenih lijekova za liječenje karcinoma koji sadrže djelatnu tvar ifosfamid kako bi se utvrdilo postoji li povećani rizik za nastanak encefalopatije (moždanih poremećaja) pri liječenju ifosfamidom farmaceutskog oblika otopine ili koncentrata za otopinu za injekciju/infuziju, u odnosu na farmaceutski oblik praška za otopinu za injekciju/infuziju.
Ifosfamid se primjenjuje u liječenju različitih vrsta karcinoma, uključujući različite čvrste tumore i karcinome krvnih stanica, poput limfoma (karcinoma bijelih krvnih stanica). Rizik encefalopatije uz primjenu ifosfamida otprije je poznat i naveden u informacijama o lijeku navedenih lijekova te je općenito reverzibilan.
U Republici Hrvatskoj nisu odobreni lijekovi koji sadrže ifosfamid u farmaceutskom obliku otopine ili koncentrata za otopinu za injekciju/infuziju. Ifosfamid je u Republici Hrvatskoj dostupan u obliku praška za otopinu za injekciju/infuziju:
- Holoxan 500 mg prašak za otopinu za injekciju/infuziju
- Holoxan 100 mg prašak za otopinu za injekciju/infuziju.
PRAC je, uzevši u obzir sve dostupne podatke, zaključio da se povećani rizik od encefalopatije uz ifosfamid u farmaceutskom obliku otopine ili koncentrata za otopinu za injekciju/infuziju ne može niti potvrditi niti isključiti s obzirom na ograničene podatke. PRAC je preporučio da se postojeće upozorenje o encefalopatiji povezanoj s ifosfamidom u informacijama o lijeku ažurira najnovijim informacijama o navedenoj nuspojavi, uključujući njene karakteristike i čimbenike rizika, te je naglasio potrebu za pomnim praćenjem bolesnika.
Postojeća upozorenja u sažetku opisa svojstava lijeka revidirat će se na način da uključuju sljedeće informacije:
- U slučaju razvoja toksičnosti u središnjem živčanom sustavu (CNS) potrebno je prekinuti primjenu ifosfamida. Navedena toksičnost uz primjenu ifosfamida može se pojaviti unutar nekoliko sati do nekoliko dana nakon primjene ovog lijeka, a u većini slučajeva do oporavka dolazi unutar 48 do 72 sata nakon prekida primjene ifosfamida.
- U bolesnika je potrebno pažljivo nadzirati eventualnu pojavu simptoma encefalopatije, posebice u bolesnika koji imaju povećan rizik za nastanak encefalopatije. Simptomi mogu uključivati konfuziju, somnolenciju, komu, halucinacije, zamućen vid, psihotično ponašanje, ekstrapiramidalne simptome, urinarnu inkontinenciju i napadaje.
- Navedena toksičnost vjerojatno je ovisna o dozi. Čimbenici rizika za razvoj encefalopatije uz primjenu ifosfamida uključuju hipoalbuminemiju, smanjenu funkciju bubrega, procijenjeno slabo opće tjelesno stanje (engl. performance status), bolest zdjelice te prethodnu ili istodobnu nefrotoksičnu terapiju, uključujući cisplatin.
- S obzirom na potencijal aditivnih učinaka, lijekovi s djelovanjem na središnji živčani sustav poput antiemetika, sedativa, narkotika ili antihistaminika, trebaju biti primjenjivani uz poseban oprez ili, ako je potrebno, treba prekinuti njihovu primjenu u slučaju nastanka encefalopatije uz ifosfamid.
Uputa o lijeku također će se ažurirati najnovijim informacijama o čimbenicima koji mogu povećati rizik od encefalopatije te uputama kako prepoznati simptome karakteristične za ovu nuspojavu.
Dodatno, nositelji odobrenja za stavljanje u promet ifosfamida u farmaceutskom obliku otopine ili koncentrata za otopinu za injekciju/infuziju trebat će provesti ispitivanja stabilnosti ovog lijeka kako bi se ustanovili optimalni uvjeti čuvanja.
Republika Hrvatska bila je suizvjestitelj u navedenom postupku pri PRAC-u.
3.1.4. Donesene preporuke za testiranje i liječenje lijekovima s djelatnim tvarima fluorouracil, kapecitabin, tegafur i flucitozin zbog nedostatka enzima DPD i povećanog rizika od teške toksičnosti
PRAC je preporučio da se bolesnici prije početka liječenja citostaticima s djelatnom tvari fluorouracil koji se primjenjuju putem injekcije ili infuzije (drip) te srodnim lijekovima s djelatnim tvarima kapecitabin i tegafur, koji se u tijelu konvertiraju u fluorouracil testiraju na nedostatak enzima dihidropirimidinske dehidrogenaze (DPD). Budući da se liječenje ozbiljnih gljivičnih infekcija ne bi trebalo odgađati, testiranje na nedostatak enzima DPD-a nije potrebno provesti prije početka liječenja flucitozinom (lijekom koji je srodan fluorouracilu). Također, testiranje nije potrebno provesti niti prije liječenja topikalnim fluorouracilom, koji se primjenjuje na koži kod liječenja različitih kožnih bolesti.
Nedostatak ili smanjena aktivnost enzima DPD-a, potrebnog za razgradnju fluorouracila, uzrokuje nakupljanje fluorouracila u krvi. To može dovesti do ozbiljnih i životno-ugrožavajućih nuspojava, poput neutropenije (smanjenja broja neutrofila, bijelih stanica za obranu od infekcija), neurotoksičnosti (oštećenja živčanog sustava), teške dijareje i stomatitisa (upale sluznice usta).
Temeljem ocjene dostupnih podataka, PRAC je donio sljedeće preporuke o mjerama za sigurnu primjenu ovih lijekova:
- U bolesnika s potpunim nedostatkom enzima DPD-a ne smije se primjenjivati fluorouracil u injekciji ili infuziji, kapecitabin ili tegafur jer potpuni nedostatak aktivnosti enzima DPD-a povećava rizik od ozbiljnih i životno-ugrožavajućih nuspojava.
- U bolesnika s djelomičnim nedostatkom enzima DPD-a potrebno je razmotriti uvođenje niže početne doze ovih lijekova. Budući da djelotvornost smanjene doze nije ustanovljena, sljedeće doze mogu se povisiti ako nema ozbiljnih nuspojava. Redovito praćenje razine fluorouracila u krvi u bolesnika koji primaju fluorouracil putem infuzije može poboljšati ishode liječenja.
- Testiranje prije početka liječenja ili prilagodba doze temeljena na aktivnosti enzima DPD-a nisu potrebni u bolesnika koji primjenjuju topikalni fluorouracil. Apsorpcija fluorouracila kroz kožu iznimno je niska te se ne očekuje utjecaj na sigurnost primjene topikalnog fluorouracila u pacijenata s djelomičnim ili potpunim nedostatkom enzima DPD-a.
- Flucitozin se koristi u liječenju ozbiljnih infekcija uzrokovanih kvascima i gljivicama, uključujući neke vrste meningitisa (upale ovojnice mozga i leđne moždine). Kako ne bi došlo do odgode započinjanja liječenja, nije potrebno testirati bolesnike na nedostatak enzima DPD-a. Bolesnici s ranije utvrđenim potpunim nedostatkom enzima DPD-a ne smiju primjenjivati flucitozin zbog rizika od nastanka životno-ugrožavajućih nuspojava. Bolesnici s djelomičnim nedostatkom enzima DPD-a imaju povećani rizik od pojave ozbiljnih nuspojava. U slučaju pojave nuspojava, liječnik treba razmotriti prestanak liječenja flucitozinom. Testiranje aktivnosti enzima DPD-a također se može razmotriti, s obzirom na to da je rizik od ozbiljnih nuspojava veći u bolesnika sa smanjenom aktivnošću enzima DPD-a.
Fluorouracil, koji se primjenjuje putem injekcije ili infuzije te njegovi prolijekovi kapecitabin i tegafur, koji se u tijelu konvertiraju u fluorouracil, a koji se primjenjuju putem usta, primjenjuju se u liječenju karcinoma. Djeluju na način da interferiraju s enzimima koji su uključeni u nastanak nove DNA, pritom blokirajući rast stanica karcinoma. Fluorouracil koji se primjenjuje na koži koristi se kod različitih kožnih bolesti, poput aktiničke keratoze i kožnih bradavica.
U Republici Hrvatskoj dostupni su sljedeći lijekovi s djelatnom tvari fluorouracil:
- Fluorouracil Pliva 50 mg/ml otopina za injekciju/infuziju
- Fluorouracil Sandoz 50 mg/ml otopina za injekciju/infuziju
- Verrucutan 5 mg/g + 100 mg/g otopina za kožu.
U Republici Hrvatskoj dostupni su sljedeći lijekovi s djelatnom tvari kapecitabin:
- Cansata 150 mg filmom obložene tablete
- Cansata 500 mg filmom obložene tablete
- Capecitabine Accord
- Capecitabine Medac
- Capecitabine Teva
- Ecansya
- Kapecitabin JGL 150 mg filmom obložene tablete
- Kapecitabin JGL 500 mg filmom obložene tablete
- Kapecitabin Sandoz 500 mg filmom obložene tablete
- Kapetral 150 mg filmom obložene tablete
- Kapetral 500 mg filmom obložene tablete
- Xalvobin 500 mg filmom obložene tablete
- Xeloda.
U Republici Hrvatskoj dostupan je sljedeći lijek s djelatnom tvari tegafur:
- Teysuno 15 mg/4,35 mg/11,8 mg tvrde kapsule
- Teysuno 20 mg/5,8 mg/15,8 mg tvrde kapsule.
U Republici Hrvatskoj nisu odobreni lijekovi koji sadrže djelatnu tvar flucitozin.
Zbog navedenih preporuka upućeno je pismo zdravstvenim radnicima, javnost je obaviještena putem internetskih stranica HALMED-a, a preporuke će biti uključene u informacije o lijekovima namijenjene liječnicima i bolesnicima.
3.1.5. Ograničenje indikacije, dodatne kontraindikacije i mjere minimizacije rizika za lijek Lemtrada (alemtuzumab)
U 2020. godini upućeno je pismo zdravstvenim radnicima o ograničenju indikacije, dodatnim kontraindikacijama i mjerama minimizacije rizika za lijek Lemtrada (alemtuzumab) zbog rizika od ozbiljnih nuspojava, u pojedinim slučajevima sa smrtnim ishodom.
Uvedeno je sljedeće ograničenje indikacije:
- Lijek Lemtrada indiciran je kao monoterapija koja mijenja tijek bolesti kod visoko aktivne relapsno-remitentne multiple skleroze (RRMS) za sljedeće skupine odraslih bolesnika:
- Bolesnici u kojih je bolest visoko aktivna unatoč cjelovitom i odgovarajuće provedenom liječenju barem jednim lijekom koji mijenja tijek bolesti.
- Bolesnici s brzim razvojem teškog oblika RRMS, što se definira pojavom dva ili više relapsa koji onesposobljuju bolesnika tijekom jedne godine te pojavom jedne ili više lezija naglašenih gadolinijevim kontrastnim sredstvom vidljivih na snimci mozga magnetskom rezonancijom ili značajnim povećanjem broja T2 lezija u usporedbi s prethodnom, nedavno učinjenom magnetskom rezonancijom.
Uvedene su sljedeće dodatne kontraindikacije:
- Teške aktivne infekcije sve do potpunog izlječenja
- Nekontrolirana hipertenzija
- Arterijska disekcija cervikocefaličnih arterija u povijesti bolesti
- Moždani udar u povijesti bolesti
- Angina pektoris ili infarkt miokarda u povijesti bolesti
- Koagulopatija, liječenje antitrombocitnim lijekovima ili antikoagulansima
- Istovremene druge autoimune bolesti pored multiple skleroze.
Uvedene su sljedeće mjere minimizacije rizika:
- Lijek Lemtrada se smije primjenjivati samo u bolnicama s dostupnom intenzivnom skrbi s obzirom na to da se tijekom ili nedugo nakon infuzije mogu pojaviti ozbiljne nuspojave poput ishemije ili infarkta miokarda, moždanog ili plućnog krvarenja. Bolesnike je potrebno pomno nadzirati i uputiti da se jave svome liječniku ako se nedugo nakon infuzije pojave bilo kakvi znakovi ili simptomi ozbiljnih nuspojava.
- Bolesnike je potrebno nadzirati radi pojave autoimunih poremećaja barem 48 mjeseci nakon zadnje infuzije te ih treba obavijestiti da se ti poremećaji mogu pojaviti i nakon proteka 48 mjeseci od zadnje infuzije.
3.1.6. Izmjena formulacije lijeka Solu-Medrol 40 mg prašak i otapalo za otopinu za injekciju/infuziju (metilprednizolon) s laktozom u formulaciju bez laktoze
U 2020. godini upućeno je pismo zdravstvenim radnicima o izmjeni formulacije lijeka Solu-Medrol 40 mg prašak i otapalo za otopinu za injekciju/infuziju (metilprednizolon) s laktozom u formulaciju bez laktoze, zbog minimizacije rizika ozbiljnih alergijskih reakcija koje su zabilježene u bolesnika alergičnih na proteine kravljeg mlijeka. Lijek Solu-Medrol 40 mg sadržavao je kao pomoćnu tvar laktozu proizvedenu iz kravljeg mlijeka te su u bolesnika alergičnih na proteine kravljeg mlijeka pri intravenskoj ili intramuskularnoj primjeni zabilježene ozbiljne alergijske reakcije. Zbog navedenih nuspojava primjena ovog lijeka bila je kontraindicirana u bolesnika za koje je poznato ili se sumnja da su alergični na proteine kravljeg mlijeka. Promjenu sastava zatražio je PRAC u sklopu ranije provedenog arbitražnog postupka. Pomoćna tvar laktoza zamijenjena je saharozom.
Zbog izmjene formulacije lijeka poduzete su sljedeće mjere kako bi se olakšalo jasno raspoznavanje i razlikovanje stare formulacije lijeka s laktozom od nove formulacije bez laktoze te izbjegle moguće pogreške pri primjeni lijeka:
- Uvrštavanje oznake "BEZ LAKTOZE" na vanjsko pakiranje i naljepnice na bočicu kako bi se naznačilo da je riječ o formulaciji bez laktoze.
- Zamjena narančaste boje kapice bijelom bojom za novu formulaciju lijeka bez laktoze.
- Promjena boje grafičkog prikaza vanjskog pakiranja i naljepnice na bočici.
- Ažuriranje informacija o lijeku, odnosno uklanjanje kontraindikacije i upozorenja vezanog uz alergijske reakcije na proteine kravljeg mlijeka, jer navedene informacije nisu primjenjive za novu formulaciju lijeka bez laktoze.
S obzirom na to da je moguće da će se neko vrijeme u prometu istovremeno nalaziti obje formulacije lijeka, važno je voditi računa o njihovom razlikovanju, u skladu s prethodno navedenim uputama za raspoznavanje. Lijek s ranijom formulacijom koja sadrži laktozu može se nalaziti u prometu do isteka roka valjanosti zadnje distribuirane serije, odnosno do 31. ožujka 2022. godine. Osobito je važno paziti da bolesnici liječeni novom formulacijom lijeka bez laktoze ne prime nehotično formulaciju koja sadrži laktozu.
Lijekovi Solu-Medrol 125 mg, 250 mg, 500 mg i 1000 mg prašak i otapalo za otopinu za injekciju/infuziju (metilprednizolon) ne sadrže laktozu kao pomoćnu tvar.
3.1.7. Važna sigurnosna izmjena i nove preporuke za prevenciju oštećenja jetre uzrokovanog lijekom Esbriet (pirfenidon)
Esbriet (pirfenidon) je lijek koji se primjenjuje za liječenje idiopatske plućne fibroze (IPF). U bolesnika liječenih ovim lijekom zabilježeni su teški slučajevi oštećenja jetre, u pojedinim slučajevima sa smrtnim ishodom. Zbog navedenog rizika upućeno je pismo zdravstvenim radnicima, javnost je obaviještena putem internetskih stranica HALMED-a, a informacije o lijeku ažurirane su sljedećim podacima:
- Potrebno je provesti testove funkcije jetre (ALT, AST, bilirubin) prije početka liječenja lijekom Esbriet (pirfenidon), potom svaki mjesec tijekom prvih šest mjeseci liječenja, a zatim svaka tri mjeseca za vrijeme daljnjeg trajanja liječenja.
- Potrebno je hitno procijeniti kliničko stanje bolesnika i provesti testove funkcije jetre u bolesnika sa simptomima koji bi mogli ukazivati na oštećenje jetre uzrokovano lijekom, kao što su, primjerice, umor, anoreksija, nelagoda u gornjem desnom dijelu abdomena, tamna mokraća ili žutica.
- Zbog porasta razine transaminaza može biti potrebno smanjiti dozu lijeka te privremeno ili trajno prekinuti primjenu lijeka Esbriet (pirfenidon). U slučaju značajnog porasta razine jetrenih aminotransferaza s hiperbilirubinemijom ili pojave kliničkih znakova i simptoma oštećenja jetre uzrokovanih lijekom, potrebno je trajno prekinuti liječenje lijekom Esbriet (pirfenidon).
3.1.8. Rizik od oštećenja jetre uzrokovanog lijekovima koji sadrže metamizol
Metamizol se primjenjuje u odraslih i adolescenata starijih od 15 godina za kratkotrajno liječenje jake akutne boli, ako su druge terapijske mjere neučinkovite ili kontraindicirane nakon traume ili operacije, kod bubrežnih i žučnih kolika i drugih akutnih stanja te za snižavanje povišene tjelesne temperature (vrućice), ako su druge terapijske mjere neučinkovite ili kontraindicirane.
U Republici Hrvatskoj dostupni su sljedeći lijekovi s djelatnom tvari metamizol:
- Alkagin 2,5 g/5 ml otopina za injekciju/infuziju
- Analgin 500 mg tablete
Uz primjenu lijekova s djelatnom tvari metamizol zabilježeni su slučajevi oštećenja jetre. Zbog navedenog rizika upućeno je pismo zdravstvenim radnicima, javnost je obaviještena putem internetskih stranica HALMED-a, a informacije o ovoj nuspojavi i odgovarajuće upozorenje uvršteni su u dokumente o lijeku.
Bolesnike je potrebno savjetovati kako prepoznati rane simptome koji mogu ukazivati na oštećenje jetre uzrokovano lijekom, savjetovati da prestanu uzimati lijek u slučaju pojave navedenih simptoma te da zatraže liječničku pomoć kako bi se procijenilo i pratilo stanje funkcije jetre. Metamizol se ne smije ponovno uvesti u liječenje bolesnika u kojih je prethodno došlo do oštećenja jetre tijekom liječenja, a za koje nije utvrđen nikakav drugi uzrok.
3.1.9. Izmjena formulacije lijeka Euthyrox
Lijek Euthyrox sadrži djelatnu tvar levotiroksinnatrij i primjenjuje se za liječenje hipotireoze (manjka ili izostanka lučenja hormona štitne žlijezde) te u stanjima u kojima je neophodno potisnuti izlučivanje tireotropina, hormona koji stimulira rad štitne žlijezde, poznatijeg kao TSH. Terapijska doza lijeka u pojedinog bolesnika određuje se u skladu sa simptomima i vrijednostima tireotropina.
Od 30. rujna 2019. godine na tržištu Republike Hrvatske dostupna je nova formulacija lijeka Euthyrox tablete. Nova formulacija lijeka ima poboljšanu stabilnost djelatne tvari tijekom cijelog roka valjanosti lijeka te je izmijenjen sastav pomoćnih tvari. Pomoćna tvar laktoza, s poznatim učinkom u bolesnika s nepodnošenjem laktoze, uklonjena je i zamijenjena pomoćnom tvari manitol te je dodana bezvodna limunska kiselina. Djelatna tvar lijeka, levotiroksinnatrij, ostala je ista odnosno nije promijenjena u odnosu na raniju formulaciju lijeka. Način uzimanja lijeka nije promijenjen.
Budući da se radi o lijeku uske terapijske širine, prilikom prelaska na novu formulaciju lijeka može doći do neravnoteže hormona štitne žlijezde, zbog čega se preporučuje pažljivo praćenje bolesnika, koje uključuje kliničku i laboratorijsku procjenu kako bi se osiguralo da svaki pojedini bolesnik i dalje uzima odgovarajuću dozu. Osobitu je pozornost potrebno posvetiti osjetljivim skupinama (npr. bolesnicima s rakom štitne žlijezde, kardiovaskularnom bolešću, trudnicama, djeci i starijim osobama).
Zbog navedenog je upućeno pismo zdravstvenim radnicima, javnost je obaviještena putem internetskih stranica HALMED-a te su izdane preporuke za liječnike koji propisuju lijek i za ljekarnike koji izdaju lijek.
Početkom 2020. godine HALMED je zaprimio povećani broj prijava sumnji na nuspojave za novu formulaciju lijeka Euthyrox. Najčešće zabilježene nuspojave odnosile su se na probavne tegobe, uključujući bolove i/ili grčeve u želucu, mučninu, dijareju, povećanje tjelesne težine, glavobolju, omaglicu, nesanicu, umor, opću slabost, osjećaj lupanja srca, aritmije, ubrzane otkucaje srca, povećan krvni tlak te pritisak, stezanje i/ili bol u prsima. Prijave sumnji na nuspojave zaprimljene za novu formulaciju lijeka nisu odudarale od prijava sumnji na nuspojave zaprimljenih za staru formulaciju lijeka.
3.2. Pregled ostalih pitanja vezanih uz sigurnost primjene lijekova u 2020. godini
3.2.1. HALMED, HZJZ i HFD proveli su kampanju o važnosti cijepljenja u sklopu Europskog i Svjetskog tjedna cijepljenja
Europski i Svjetski tjedan cijepljenja globalna su inicijativa Svjetske zdravstvene organizacije koja podsjeća da je cijepljenje osnovno pravo pojedinca na zdravstvenu zaštitu, ali i zajednička odgovornost svakog pojedinca za zaštitu javnog zdravlja. Europski i Svjetski tjedan cijepljenja održao se od 24. do 30. travnja 2020. godine pod sloganom "Cjepiva djeluju. Zdravlje za sve." ("Vaccine Work for All."), a kampanja je bila usmjerena na činjenicu da su cjepiva, stručnjaci koji ih razvijaju i distribuiraju, zdravstveno osoblje koje obavlja cijepljenje te sve osobe koje se cijepe prvaci cijepljenja jer zajednički djeluju u zaštiti javnog zdravlja. HALMED je u suradnji s Hrvatskim zavodom za javno zdravstvo (HZJZ) i Hrvatskim farmaceutskim društvom (HFD) i ove godine pružio podršku u provedbi kampanje putem društvenih mreža, naglašavajući kako važnost cijepljenja osobito dolazi do izražaja u kontekstu trenutačne pandemije bolesti COVID-19.
U sklopu ovogodišnje kampanje predstavljeni su Europski informacijski portal o cijepljenju (engl. European Vaccination Information Portal) te inicijativa Koalicija za cijepljenje (engl. The Coalition for Vaccination) koja okuplja europska stručna i studentska udruženja s ciljem promicanja najboljih praksi i borbe protiv dezinformacija o cijepljenju.
Ključne poruke kampanje bile su sljedeće:
- Cijepljenje spašava živote i štiti osobe svih dobnih skupina.
- Iako je većina djece danas cijepljenja, u populaciji je još uvijek velik broj necijepljenih osoba.
- Svi možemo biti prvaci cijepljenja.
Tijekom kampanje su se isticale sljedeće važne činjenice o cijepljenju:
- Cjepiva štite od smrtonosnih bolesti.
- Dva su ključna razloga za cijepljenje: zaštita sebe i drugih!
- Svi sastojci u cjepivima pridonose njihovoj djelotvornosti i sigurnosti primjene.
- Važno je dobiti potrebno cjepivo - na vrijeme, svaki put!
Tijekom Europskog i Svjetskog tjedna cijepljenja, HALMED, HZJZ i HFD isticali su kako su cjepiva opsežno i vrlo strogo regulirana i kontrolirana, čime je osigurana najviša razina zaštite zdravlja pacijenata i javnog zdravlja. Kao jedna od najučinkovitijih i najuspješnijih javnozdravstvenih mjera, cijepljenje je spasilo te nastavlja spašavati više ljudskih života nego bilo koja druga medicinska intervencija u povijesti. Informacije o cjepivima u Republici Hrvatskoj pacijenti i zdravstveni radnici mogu pronaći na internetskoj stranici HALMED-a.
3.2.2. HALMED u suradnji s HFD-om proveo kampanju o važnosti prijavljivanja sumnji na nuspojave lijekova
HALMED je u suradnji s HFD-om četvrtu godinu zaredom proveo kampanju o važnosti prijavljivanja sumnji na nuspojave lijekova. Kampanja je provedena putem društvenih mreža HFD-a od 2. do 8. studenog 2020. godine, u sklopu Europskog tjedna svjesnosti o važnosti prijava sumnji na nuspojave. Poruka ovogodišnje kampanje glasila je "Svaka prijava je važna!", s ciljem ukazivanja na važnost prijavljivanja svake sumnje na nuspojavu, čime pacijenti i zdravstveni radnici pridonose sigurnijoj primjeni lijekova za sve. U provedbi kampanje popraćene kao #MedSafetyWeek uz HALMED su sudjelovala regulatorna tijela i drugi dionici iz 75 država Europske unije i svijeta.
Kampanjom je istaknuto da su lijekovi koji su odobreni za stavljanje u promet sigurni, djelotvorni i odgovarajuće kakvoće, no uz njihovu primjenu mogu se javiti nuspojave. Jednako tako, istaknuto je da je teško predvidjeti kod koga će se nuspojava javiti, stoga svaka nova prijava sumnje na nuspojavu lijeka pomaže u procesu prikupljanja podataka koji omogućuju bolje razumijevanje sigurnosnog profila lijeka te propisivanje i uzimanje lijekova na najsigurniji mogući način.
U sklopu kampanje zdravstveni radnici i pacijenti/korisnici lijeka pozvani su da prijave svaku sumnju na nuspojavu lijeka i na taj način aktivno pridonesu praćenju i očuvanju sigurnosti primjene lijeka. Praćenjem nuspojava pacijentima/korisnicima lijeka u Republici Hrvatskoj kontinuirano se osiguravaju kvalitetni i sigurni lijekovi te se izravno pridonosi zaštiti javnoga zdravlja, kao i zdravlja svakog pojedinog pacijenta/korisnika lijeka.
Ciljnim publikama kampanje ukazivano je na to da je sumnju na nuspojavu lijeka moguće prijaviti HALMED-u putem mobilne aplikacije HALMED (App Store, Google Play) ili putem on-line aplikacije dostupne na internetskoj stranici HALMED-a, dok zdravstveni radnici sumnju na nuspojavu lijeka također mogu prijaviti i putem sustava OPeN. Dodatno, komunicirano je da je sumnju na nuspojavu lijeka moguće prijaviti i slanjem ispunjenog Obrasca za prijavu sumnje na nuspojavu e-poštom, telefaksom ili poštom.
Europski tjedan svjesnosti o važnosti prijava sumnji na nuspojave provodi se u sklopu globalne inicijative koju predvodi Uppsala Monitoring Centre (UMC), suradni centar Svjetske zdravstvene organizacije zadužen za vođenje Svjetske baze nuspojava, u suradnji s Mrežom nacionalnih agencija za lijekove (HMA) i Međunarodnom koalicijom regulatornih tijela za lijekove (ICMRA).
3.3. Informacije vezane uz bolest COVID-19
3.3.1. Odobren prvi lijek za liječenje bolesti COVID-19
Temeljem preporuke Povjerenstva za humane lijekove (CHMP) pri EMA-i, Europska komisija je u srpnju 2020. godine donijela Provedbenu odluku o izdavanju uvjetnog odobrenja za stavljanje u promet lijeka Veklury, čija je djelatna tvar remdesivir. Lijek je namijenjen za liječenje bolesti COVID-19 u odraslih i adolescenata starijih od 12 godina s pneumonijom čije liječenje zahtijeva primjenu dodatnog kisika.
Djelatna tvar lijeka Veklury, remdesivir, je inhibitor virusne RNA polimeraze. Djeluje na način da ometa proizvodnju virusne RNA (genetskog materijala), sprečavajući razmnožavanje virusa unutar stanica. Na taj način može pomoći tijelu da prebrodi virusnu infekciju, a bolesnicima pomaže da se brže oprave. Lijek se primjenjuje infuzijom (drip) u venu te je njegova primjena ograničena na zdravstvene ustanove u kojima se bolesnici mogu pomno nadzirati. Pritom je potrebno pratiti funkciju jetre i bubrega prije i tijekom liječenja, kako je prikladno.
Veklury je prvi lijek protiv bolesti COVID-19 za koji je podnesen zahtjev za davanje odobrenja u Europskoj uniji (EU). Uvjetno odobrenje za stavljanje u promet jedna je od ubrzanih europskih regulatornih procedura koja omogućuje raniju dostupnost lijekova za liječenje bolesti za koje još ne postoji odgovarajuće terapijsko rješenje, uključujući izvanredne javnozdravstvene situacije poput trenutačne pandemije bolesti COVID-19.
Odluka Europske komisije o davanju odobrenja za stavljanje predmetnog lijeka u promet važeća je za sve države članice EU-a, uključujući Republiku Hrvatsku. Prije davanja odobrenja, pacijentima u EU-u remdesivir je mogao biti dostupan putem kliničkih ispitivanja i postupka milosrdnog davanja lijeka.
3.3.2. Pozitivna ocjena primjene deksametazona u liječenju pojedinih bolesnika oboljelih od bolesti COVID-19
Povjerenstvo za humane lijekove (CHMP) pri EMA-i završilo je ocjenu rezultata ispitivanja koje se odnosilo na primjenu lijeka koji sadrži djelatnu tvar deksametazon u liječenju hospitaliziranih bolesnika oboljelih od bolesti COVID-19. Zaključeno je da se deksametazon može razmotriti kao opcija u liječenju bolesnika čije zdravstveno stanje zahtijeva terapiju kisikom (od primjene dodatnog kisika do mehaničke ventilacije).
Deksametazon je lijek koji pripada skupini kortikosteroida. Lijekovi koji sadrže deksametazon u EU-u su dostupni već nekoliko desetljeća, a primjenjuju se kroz usta ili injekcijom za liječenje niza upalnih stanja te za ublažavanje imunosnog odgovora u liječenju alergija i autoimunih bolesti. Također se primjenjuju zajedno s terapijom protiv zloćudnih bolesti u liječenju određenih karcinoma te za sprječavanje povraćanja. Deksametazon se počeo razmatrati kao potencijalna terapija za liječenje bolesnika oboljelih od bolesti COVID-19 zbog svog djelovanja na smanjenje upale, koja ima važnu ulogu u razvoju bolesti u pojedinih hospitaliziranih bolesnika.
Temeljem ocjene dostupnih podataka, EMA je odobrila primjenu deksametazona u odraslih i adolescenata (starijih od 12 godina i tjelesne mase iznad 40 kg) kojima je potrebno liječenje dodatnim kisikom, a lijek se može primijeniti kroz usta ili putem intravenske injekcije ili infuzije (drip).
3.3.3. EMA započela postupnu ocjenu četiriju cjepiva protiv bolesti COVID-19 i odobreno prvo cjepivo protiv bolesti COVID-19
U 2020. godini Povjerenstvo za humane lijekove (CHMP) EMA-e započelo je postupnu ocjenu četiriju cjepiva protiv bolesti COVID-19:
- Cjepivo proizvođača AstraZeneca, sadašnjeg naziva Vaxzevria, ranijeg naziva COVID-19 Vaccine AstraZeneca
- Cjepivo proizvođača BioNTech i Pfizer, sadašnjeg naziva Comirnaty
- Cjepivo proizvođača Moderna Biotech Spain, S.L., sadašnjeg naziva Spikevax, ranijeg naziva COVID-19 Vaccine Moderna
- Cjepivo proizvođača Janssen Vaccines & Prevention BV, sadašnjeg naziva COVID-19 Vaccine Janssen
Cjepiva Comirnaty i Spikevax su cjepiva koja sadrže molekulu glasničke ribonukleinske kiseline, mRNA, obloženu lipidnim nanočesticama koje sprječavaju razgradnju molekule mRNA nakon ulaska u organizam. Nakon primjene cjepiva, molekula mRNA organizmu daje uputu za stvaranje proteina šiljka (engl. Spike Protein), proteina koji se inače nalazi na površini stanica virusa SARS-CoV-2.
Cjepiva Vaxzevria i COVID-19 Vaccine Janssen su cjepiva koja sadrže viruse iz roda adenovirusa koji su izmijenjeni tako da se u organizmu ne mogu umnažati. Nakon ulaska u organizam, ovi adenovirusi djeluju kao vektori koji kodiraju stvaranje proteina šiljka virusa SARS-CoV-2.
Imunološki sustav organizma nakon primjene ovih cjepiva prepoznat će stvoreni protein šiljka kao strani protein te će, kao prirodnu obranu organizma protiv ovog proteina, proizvesti protutijela i T-stanice. Ako u budućem razdoblju cijepljena osoba dođe u kontakt s virusom SARS-CoV-2, imunološki sustav prepoznat će virus i bit će spreman za napad; protutijela i T-stanice zajednički će djelovati na ubijanje virusa, sprječavajući njegov ulazak u stanice organizma i uništavajući zaražene stanice, čime pomažu u zaštiti protiv bolesti COVID-19.
Nakon što je EMA dana 21. prosinca 2020. godine preporučila davanje uvjetnog odobrenja za stavljanje u promet cjepiva Comirnaty proizvođača BioNTech i Pfizer, Europska komisija je istoga dana donijela Provedbenu odluku o davanju uvjetnog odobrenja za stavljanje predmetnog cjepiva protiv bolesti COVID-19 u promet. Ovo odobrenje važeće je u svim državama članicama EU-a i zemljama Europskog gospodarskog prostora, uključujući Republiku Hrvatsku.





