Izvješće o nuspojavama u 2014. godini
- 1. Uvod
- 2. Prijave sumnji na nuspojave u 2014. godini
- 2.1. Izvori prijava
- 2.2. Karakteristike prijava nuspojava lijekova i cjepiva
- 2.2.1. Klasifikacija lijekova
- 2.2.2. Dob i spol bolesnika
- 2.2.3. Vrste nuspojava
- 2.2.4. Broj lijekova u istovremenoj primjeni
- 2.2.5. Ozbiljnost nuspojave
- 2.2.6. Ishod nuspojave
- 2.2.7. Nuspojave po organskim sustavima
- 2.2.8. Najčešće prijavljene nuspojave u 2014. godini
- 3. Pregled sigurnosnih pitanja u 2014. godini
- 3.1. Pregled najvažnijih sigurnosnih regulatornih mjera poduzetih u 2014. godini
- 3.1.1. Lijekovi koji sadrže valproat i srodne tvari
- 3.1.2. Lijekovi koji sadrže bromokriptin
- 3.1.3. Lijekovi koji djeluju na renin-angiotenzinski sustav
- 3.1.4. Lijekovi koji sadrže testosteron
- 3.1.5. Lijekovi koji sadrže zolpidem
- 3.1.6. Lijekovi namijenjeni za hitnu kontracepciju
- 3.1.7. Lijek ellaOne
- 3.1.8. Lijekovi Procoralan i Corlentor
- 3.1.9. Transdermalni flasteri koji sadrže fentanil
- 3.2. Pregled ostalih pitanja vezanih uz sigurnost primjene lijekova u 2014. godini
- 3.2.1. HALMED obilježio 40 godina spontanog prijavljivanja nuspojava u Hrvatskoj
- 3.2.2. HALMED ocijenjen jednom od najboljih agencija u EU regulatornoj mreži lijekova
- 3.2.3. Suradnjom HALMED-a i HZZO-a Pisma zdravstvenim radnicima postala dostupna u CEZIH-u
- 3.2.4. HALMED aktivno uključen u europske projekte vezane uz sigurnost primjene lijekova
- 3.2.5. HALMED sudjelovao u obilježavanju Međunarodnog dana rijetkih bolesti
- 3.2.6. HALMED domaćin značajnih međunarodnih farmakovigilancijskih skupova
1. Uvod
Na temelju Zakona o lijekovima (Narode novine, br. 73/13., 90/14.) i pripadajućeg Pravilnika o farmakovigilanciji (Narodne novine, br. 83/13.) Agencija za lijekove i medicinske proizvode - HALMED (u daljnjem tekstu HALMED) prati nuspojave zabilježene u Republici Hrvatskoj koje su zdravstveni radnici i nositelji odobrenja za stavljanje lijeka u promet obvezni prijavljivati. HALMED također zaprima izravne prijave nuspojava lijekova od pacijenata. HALMED prati nuspojave lijekova iz prometa i nuspojave zabilježene u kliničkim ispitivanjima.
Ovo je deseto (10.) izvješće o prijavama nuspojava zaprimljenima iz Republike Hrvatske koje je izradio HALMED.
2. Prijave sumnji na nuspojave u 2014. godini
Tijekom 2014. godine HALMED je zaprimio ukupno 3112 prijava sumnji na nuspojave u Republici Hrvatskoj.
Ukupan broj prijava sumnji na nuspojave u 2014. godini u Republici Hrvatskoj čini zbroj:
- spontanih prijava nuspojava lijekova zaprimljenih u HALMED-u:
-
- spontane prijave nuspojava izravno prijavljene HALMED-u od strane zdravstvenih radnika
- nuspojave proslijeđene HALMED-u od nositelja odobrenja za stavljanje lijeka u promet koji su ih zaprimili od zdravstvenih radnika ili pacijenata
- prijave nuspojava izravno prijavljene HALMED-u od strane pacijenata/korisnika lijeka
- spontanih prijava nuspojava cjepiva zaprimljenih u HALMED-u:
-
- prijave nuspojava cjepiva koje zaprima Hrvatski zavod za javno zdravstvo (HZJZ) i prosljeđuje HALMED-u
- prijave nuspojava cjepiva koje je HALMED izravno primio od zdravstvenih radnika, nositelja odobrenja ili pacijenata
- prijava nuspojava dodataka prehrani
- ukupnog broja sumnji na ozbiljne neočekivane nuspojave (SUSAR) iz kliničkih ispitivanja koja se provode u Republici Hrvatskoj.
Broj prijava iz svake od navedenih skupina prikazan je u Tablici 1, a njihov udio na Slici 1.
Tablica 1. Prijave nuspojava po skupinama proizvoda (ukupan broj)
| Skupine | Lijekovi | Cjepiva | Dodaci prehrani | SUSAR* | UKUPNO |
|---|---|---|---|---|---|
| Broj prijava | 2658 | 276 | 20 | 158 | 3112 |
*sumnja na ozbiljnu neočekivanu nuspojavu iz kliničkih ispitivanja koja se provode u Republici Hrvatskoj
Slika 1. Udio prijava nuspojava po skupinama proizvoda
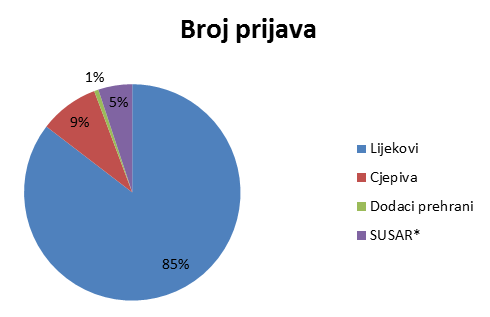
*sumnja na ozbiljnu neočekivanu nuspojavu iz kliničkih ispitivanja koja se provode u Republici Hrvatskoj
Tijekom 2014. godine HALMED je zaprimio ukupno 3112 prijava sumnji na nuspojave u Republici Hrvatskoj. Od tog broja, 22 prijave su prikupljene iz objavljenih literaturnih podataka o nuspojavama zabilježenima u RH, 158 prijava je proizašlo iz kliničkih ispitivanja ili postmarketinških neintervencijskih ispitivanja, dok je 2658 prijava prikupljeno spontanim prijavljivanjem nuspojava od strane zdravstvenih radnika i pacijenata izravno HALMED-u, putem nositelja odobrenja za stavljanje lijeka u promet ili od Hrvatskog zavoda za javno zdravstvo. Ukupno 117 prijava nuspojava lijekova zaprimljeno je od pacijenata/korisnika lijeka/zakonskih zastupnika koji su sumnju na nuspojavu prijavili izravno HALMED-u.
Ključni zaključci razmatranja dobivenih podataka su sljedeći:
- Ukupan broj prijava zabilježio je rast od 25% u odnosu na 2013. godinu (3112 prijava prema 2491 u 2013. godini)
- Pedeset tri i pol posto (53,5%) svih prijava sumnji na nuspojave u 2014. godini ishodište je imalo od strane liječnika, što je najmanji udio liječnika u prijavama nuspojava zabilježen do sada
- Udio ljekarnika u prijavama sumnji na nuspojave u 2014. godini iznosi 37%, što je nastavak trenda iz prethodnih godina i najveći udio prijava zabilježen do sada
- Broj prijava zaprimljenih od strane pacijenata u 2014. godini je 187, što čini udio od 6% svih prijava, jednako kao u 2013. godini. Putem nositelja odobrenja takvih prijava je HALMED-u proslijeđeno 70, a u ostalim slučajevima (117) prijavitelji su ujedno bili i pošiljatelji, koji su sumnju na nuspojavu prijavili izravno HALMED-u
- Među pošiljateljima prijava HALMED-u nastavljen je trend pada udjela nositelja odobrenja za stavljanje lijeka u promet u odnosu na 2013. godinu i iznosi 23% (u 2013. godini taj je udio iznosio 29%)
- U 2014. godini osjetno je veći broj prijava za nuspojave koje ne udovoljavaju kriterijima ozbiljne nuspojave (71% ne-ozbiljnih prema tek 29% ozbiljnih nuspojava; u 2013. godini taj odnos je bio 66% naspram 34%), što je trend koji zamjećujemo u posljednjih nekoliko godina kao posljedica rasta broja prijava od strane ljekarnika. Pritom, potrebno je naglasiti da ne-ozbiljne nuspojave ne znače automatski i nuspojave koje nisu teške jer i ove nuspojave također mogu smanjiti kvalitetu života pacijenata. Prijavljivanjem ne-ozbiljnih nuspojava pridonosi se boljoj obuhvatnosti svih nuspojava koje utječu na kvalitetu života pojedinaca.
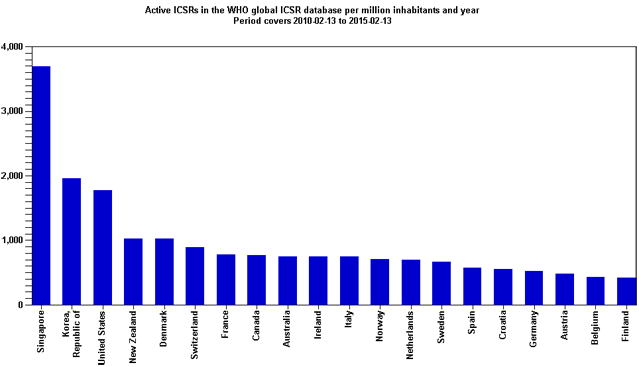
Kao što je naglašavano u Izvješćima iz prethodnih godina, broj prijava sumnji na nuspojave je indikator kvalitete samog sustava prijavljivanja nuspojava. Zahvaljujući zajedničkim naporima HALMED-a i svih zdravstvenih radnika, pacijenata i nositelja odobrenja za lijekove koji redovito prijavljuju sumnje na nuspojave, Republika Hrvatska se, po kvaliteti i broju prijava nuspojava, izraženo na milijun stanovnika, tijekom 2014. i početkom 2015. godine nalazila na 16. mjestu od 115 zemalja svijeta koje sudjeluju u programu praćenja sigurnosti lijekova Svjetske zdravstvene organizacije (WHO).
Slika 2. preuzeta je s internetske stranice Uppsala Monitoring Centra (UMC), suradnog centra Svjetske zdravstvene organizacije za praćenje nuspojava.
Slika 2. Broj prijava nuspojava na milijun stanovnika u bazi Svjetske zdravstvene organizacije (Uppsala Monitoring Centre - VigiBase), veljača 2010. - veljača 2015. godine
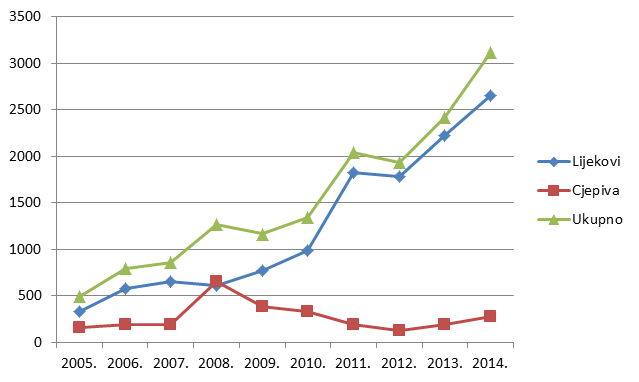
Tablica 2. Kretanje ukupnog broja prijava nuspojava (uključujući SUSAR) u Republici Hrvatskoj u posljednjih deset godina (2005. - 2014.)
| Godina | 2005. | 2006. | 2007. | 2008. | 2009. | 2010. | 2011. | 2012. | 2013. | 2014. |
|---|---|---|---|---|---|---|---|---|---|---|
| Ukupan broj prijava nuspojava | 498 | 790 | 856 | 1265 | 1165 | 1338 | 2040 | 1923 | 2491 | 3112 |
Tablica 3. Kretanje broja spontanih prijava nuspojava na lijekove i cjepiva u Republici Hrvatskoj u posljednjih deset godina (2005. - 2014.)
| Godina | 2005. | 2006. | 2007. | 2008. | 2009. | 2010. | 2011. | 2012. | 2013. | 2014. |
|---|---|---|---|---|---|---|---|---|---|---|
| Lijekovi | 336 | 579 | 655 | 611 | 776 | 983 | 1831 | 1737 | 2223 | 2658 |
| Cjepiva | 162 | 194 | 192 | 654 | 389 | 331 | 191 | 129 | 189 | 276 |
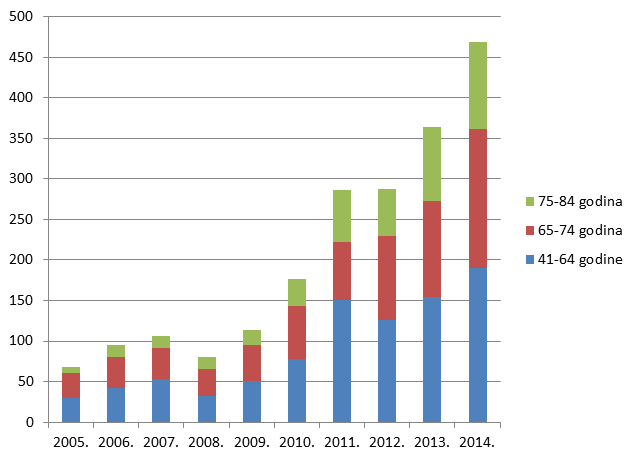
Slika 3. Kretanje broja prijava nuspojava u Republici Hrvatskoj u posljednjih deset godina (2005. - 2014.)
U 2014. godini HALMED je nastavio održavati radionice za studente farmacije i medicine, zdravstvene radnike, odgovorne osobe za farmakovigilanciju nositelja odobrenja te pacijente putem kojih ih educira o njihovoj ulozi u farmakovigilancijskom sustavu u Republici Hrvatskoj te o načinu i značaju prijavljivanja sumnji na nuspojave. U nastavku donosimo pregled predavanja i radionica iz 2014. godine:
- Dana 8. siječnja 2014. godine održano je predavanje Mjere minimizacije rizika u dvorani Hrvatskog farmaceutskog društva (HFD). Predavanje je bilo namijenjeno magistrima farmacije, aodržano je u sklopu mjesečnih predavanja Sekcije za kliničku farmaciju HFD-a.
- Dana 18. veljače 2014. godine u Osijeku u suradnji s Međunarodnom udrugom studenata medicine Hrvatske (CroMSIC) i Hrvatskim savezom za rijetke bolesti djelatnici HALMED-a održali su izlaganja o važnosti prijavljivanja nuspojava.
- Dana 19. veljače 2014. godine u Rijeci u suradnji s Međunarodnom udrugom studenata medicine Hrvatske (CroMSIC) i Hrvatskim savezom za rijetke bolesti djelatnici HALMED-a održali su izlaganja o važnosti prijavljivanja nuspojava.
- Dana 19. veljače 2014. godine u Puli u suradnji s Udrugom slijepih Istarske županije - Pula i Hrvatskim savezom za rijetke bolesti djelatnici HALMED-a održali su izlaganja o važnosti prijavljivanja nuspojava.
- Dana 20. veljače 2014. godine u Splitu u suradnji s Udrugom oboljelih od kolagenoza i Hrvatskim savezom za rijetke bolesti djelatnici HALMED-a održali su izlaganja o važnosti prijavljivanja nuspojava.
- Dana 21. veljače 2014. godine u Dubrovniku u suradnji s udrugom Zajedno do zdravlja - Udruga kronično bolesnog djeteta i Hrvatskim savezom za rijetke bolesti djelatnici HALMED-a održali su izlaganja o važnosti prijavljivanja nuspojava.
- Dana 21. veljače 2014. godine u Bjelovaru u suradnji s Udrugom tjelesnih invalida Bjelovar i Hrvatskim savezom za rijetke bolesti djelatnici HALMED-a održali su izlaganja o važnosti prijavljivanja nuspojava.
- Dana 21. veljače 2014. godine u Križevcima u suradnji s Udrugom invalida Križevci i Hrvatskim savezom za rijetke bolesti djelatnici HALMED-a održali su izlaganja o važnosti prijavljivanja nuspojava.
- Dana 27. i 28. veljače 2014. godine u Zagrebu održan je 3. Hrvatski simpozij i nacionalna konferencija o rijetkim bolestima. U sklopu navedenog skupa djelatnici HALMED-a održali su izlaganja o važnosti prijavljivanja nuspojava i ulozi Agencije u dostupnosti lijekova nakon ulaska u Europsku uniju.
- Dana 3. i 4. travnja 2014. godine u Zagrebu održana su predavanja na temu mjera minimizacije rizika i potreba pacijenata u regulatornom okviru sigurnosti primjene lijekova na međunarodnoj radionici "Proactive Pharmacovigilance, Risk Management and Pharmacovigilance in the Era of Personalised Medicine" u organizaciji Međunarodnog udruženja za farmakovigilanciju (International Society of Pharmacovigilance, ISoP) i HALMED-a. Radionice su bile namijenjene nositeljima odobrenja.
- Dana 12. svibnja 2014. godine održana je radionica "Mjere minimizacije rizika - kako unaprijediti sigurnost primjene lijeka" u KB Dubrava. Radionica je bila namijenjena liječnicima i medicinskim sestrama s ciljem upoznavanja zdravstvenih radnika s konceptom mjera minimizacije rizika (MMR), prikazivanja primjera MMR-a te različitih tipova edukacijskih materijala.
- Dana 21. svibnja 2014. godine održana je radionica "Mjere minimizacije rizika - kako unaprijediti sigurnost primjene lijeka" u Općoj bolnici Dubrovnik. Predavanje je bilo namijenjeno liječnicima i medicinskim sestrama.
- Dana 18. listopada 2014. godine na godišnjem sastanku Nacionalnih centara za praćenje nuspojava predstavnica HALMED-a održala je predavanje o mjerenju učinkovitosti mjera minimizacije rizika.
Od rujna 2005. do kraja 2014. godine HALMED je održao više od 90 radionica iz područja farmakovigilancije koje je pohađalo i uspješno završilo gotovo 1700 zdravstvenih radnika.
2.1. Izvori prijava
Najzastupljenija skupina prijavitelja tradicionalno su liječnici, koji su u 2014. godini prijavili 53,5% svih prijava sumnji na nuspojave. U ovoj je skupini ponovno zabilježen blagi pad relativnog broja prijava u odnosu na 2013. godinu, kada je ukupno 55% prijava imalo ishodište od strane liječnika.
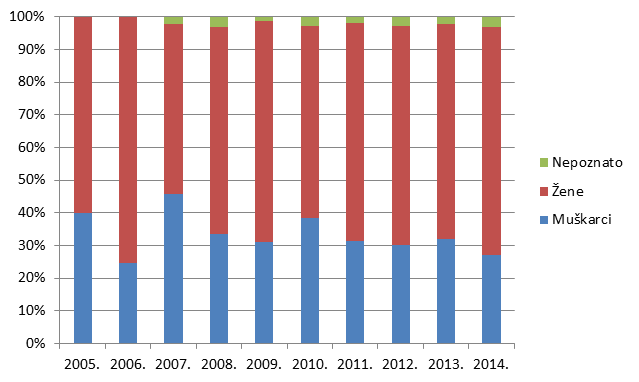
S druge strane, nastavlja se trend porasta broja prijava od strane ljekarnika, koji u 2014. godini iznosi 37% (naprema 34% u 2013., 30% u 2012., 24% u 2011., odnosno 20% u 2010. godini) (Slika 6.). Ta činjenica odražava se na brojne parametre koji se prate u Izvješću, a o čemu će biti riječi u daljnjem tekstu. Svaka skupina prijavitelja ima svoje karakteristike, a zadaća je HALMED-a svima olakšati prijavljivanje te osigurati ravnomjernu zastupljenost svih skupina kako bi se mogao steći sveobuhvatan uvid u stvarno stanje sigurnosti primjene lijekova na hrvatskom tržištu.
Tijekom 2014. godine, HALMED je zaprimio 187 prijava od pacijenata/korisnika lijeka ili njihovih zakonskih zastupnika (Tablica 4.). HALMED je tijekom rujna i listopada 2013. godine na nacionalnoj razini proveo javnu edukativnu kampanju namijenjenu promicanju važnosti čitanja upute o lijeku i prijavljivanja nuspojava među pacijentima i korisnicima lijekova koja je polučila dobre rezultate potičući prijavljivanje ne samo od strane pacijenata već i zdravstvenih radnika. Pokazalo se kako je navedena kampanja ostvarila trajniji utjecaj na prijavljivanje od strane pacijenata te je, kako smo očekivali u prošlom Izvješću, ostvaren jednaki udio prijava od strane pacijenata kao i u 2013. godini (6%). Za daljnji iskorak po pitanju broja prijava od strane pacijenata bit će potrebne nove inicijative u svrhu promicanja važnosti prepoznavanja i prijavljivanja nuspojava.
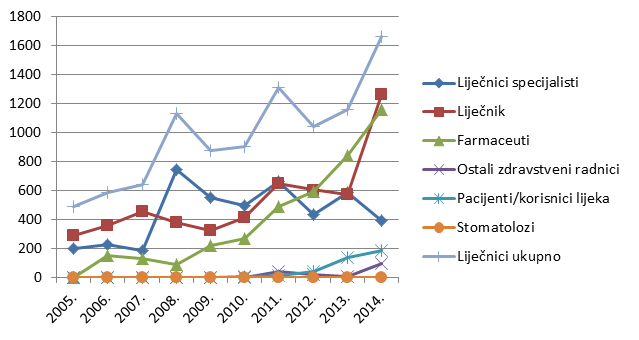
Slika 4. Kretanje ukupnog broja prijavitelja - zdravstvenih radnika u razdoblju od 2007. do 2014. godine
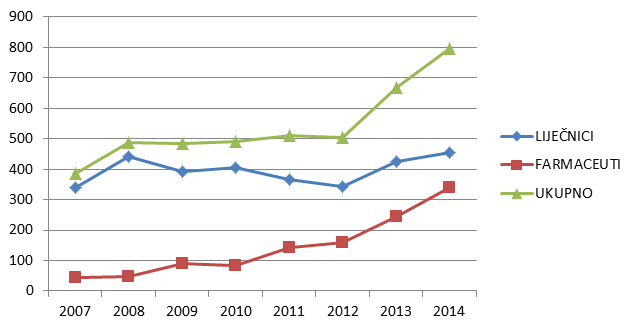
Slika 4. pokazuje kretanje ukupnog broja prijavitelja kroz razdoblje od 2007. do 2014. godine. U posljednje tri godine doživljavamo značajan porast broja prijavitelja - zdravstvenih radnika, i to prije svega kao funkciju porasta broja pojedinačnih prijavitelja iz redova farmaceuta (ljekarnika).
U 2014. godini zabilježen je najveći broj pojedinačnih prijavitelja otkad HALMED provodi ovu vrstu analize. Činjenica da je u cjelokupni sustav spontanog prijavljivanja sumnji na nuspojave uključeno nešto manje od 800 zdravstvenih radnika pokazuje veliki prostor za nadograđivanje sustava i postizanje njegove optimalne učinkovitosti.
HALMED je u 2014. godini zaprimio 728 prijava od strane nositelja odobrenja za stavljanje lijeka u promet, što čini 23% ukupnog broja prijava i pokazuje pad u odnosu na 2013. godinu.
Tablica 4. Izvori prijava sumnji na nuspojave lijekova i cjepiva u 2014. godini prema struci prijavitelja
| Izvor prijave | Broj prijava |
|---|---|
| Liječnik (bez specijalizacije ili specijalizacija nije navedena) | 1267 |
| Liječnici specijalisti (ukupno) | 398 |
| Specijalist obiteljske medicine | 171 |
| Pedijatar | 20 |
| Specijalist školske medicine | 15 |
| Psihijatar | 30 |
| Internist | 14 |
| Dermatovenerolog | 16 |
| Reumatolog | 10 |
| Epidemiolog | 3 |
| Radiolog | 14 |
| Ginekolog | 7 |
| Infektolog | 7 |
| Nefrolog | 2 |
| Pulmolog | 7 |
| Klinički farmakolog | 3 |
| Neurolog | 7 |
| Endokrinolog | 2 |
| Gastroenterolog | 10 |
| Anesteziolog | 10 |
| Kardiolog | 2 |
| Onkolog | 8 |
| Spec. medicine rada | 13 |
| Transfuziolog | 14 |
| Kirurg | 7 |
| Oftalmolog | 3 |
| Urolog | 3 |
| Farmaceuti | 1159 |
| Stomatolozi | 1 |
| Nepoznat izvor (≈zdravstveni radnici nepoznatog profila) | 100 |
| Pacijenti | 187 |
| UKUPNO | 3112 |
Slika 5. Kretanje broja prijava po izvorima prijavitelja u razdoblju od 2005. do 2014. godine
U svim prošlogodišnjim prijavama bilo je moguće identificirati pojavljuje li se u ulozi prijavitelja zdravstveni radnik ili pacijent. To predstavlja ogroman kvalitativan pomak u obradi prijava sumnji na nuspojave u odnosu na sva dosad objavljena Izvješća. U razdoblju koje slijedi napore ćemo usmjeriti prema boljem razumijevanju kojim se specijalnostima moramo posebno obraćati kako bismo upotpunili sliku sigurnosti primjene lijekove iz svih ATK skupina.
Slika 6. Udio prijava prema struci prijavitelja - zdravstvenih radnika u razdoblju od 2005. do 2014. godine
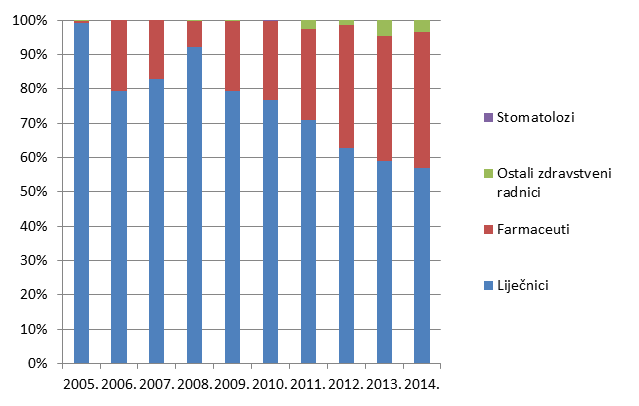
Slika 6. pokazuje udio pojedinih zdravstvenih radnika u prijavljivanju nuspojava u kojem tradicionalno dominiraju liječnici. Od 2008. godine udio prijava od strane farmaceuta raste i trenutno čini 37% svih prijava nuspojava, što je najveći do sada zabilježeni udio. Prijave od strane drugih skupina zdravstvenih radnika su, nažalost, još uvijek malobrojne stoga HALMED planira dodatne edukacije u svrhu poticanja prijavljivanja nuspojava.
Broj prijava iz bolničkih ustanova u 2014. godini iznosio je 425, a udio u ukupnom broju prijava iznosio je 14% (Tablica 5.). Budući da za više od 800 prijava nije točno specificirana ustanova iz koje je nuspojava prijavljena, vjerojatno je da se neke nuspojave iz bolnica kriju u ovim prijavama. Iako je udio prijava iz bolničkih ustanova porastao u odnosu na 2013. godinu (11%), HALMED smatra kako je trenutni udio prijava iz bolničkih ustanova i dalje prenizak. Kao rješenje za postojeće stanje, nameće se potreba za integracijom sustava za prijavu nuspojava u bolničke informatičke sustave, kao i za dodatnom edukacijom o potrebi prijavljivanja nuspojava. Prvi koraci rješenju preniskog udjela prijava učinjeni su u 2014. godini kroz osnaživanje suradnje s Hrvatskim zavodom za zdravstveno osiguranje, a potpunu integraciju sustava prijavljivanja iz programskih rješenja za ordinacije primarne zdravstvene zaštite, ljekarne, bolničke informacijske sustave (BIS) i programska rješenja za bolnice koje nemaju BIS (BSN) očekujemo kroz sljedećih nekoliko godina. Nuspojave iz bolničkih ustanova od osobitog su značaja jer obično produžuju hospitalizaciju ili dovode do hospitalizacije pa time uvijek pripadaju kategoriji ozbiljnih nuspojava.
Tablica 5. Izvori spontanih prijava sumnji na nuspojave prema zdravstvenim ustanovama u 2014. godini
| Ustanova | Broj prijava |
|---|---|
| Ljekarna | 1105 |
| Ordinacija obiteljske medicine | 486 |
| Klinička bolnica ili klinički bolnički centar | 245 |
| Opća bolnica | 90 |
| Zavod za javno zdravstvo | 152 |
| Pedijatrijska ordinacija | 35 |
| Specijalna bolnica | 90 |
| Ostalo* | 40 |
| Nepoznato | 869 |
| UKUPNO PRIJAVA: | 3112 |
*prijave iz ustanova koje nisu obuhvaćene drugim navedenim kriterijima, a koje obuhvaćaju, primjerice, prijave pristigle iz privatnih specijalističkih ordinacija ili prijave zaprimljene od medicinski kvalificiranog pacijenta.
Slika 7. Udio pojedinih ustanova kao izvora prijave nuspojave u 2014. godini
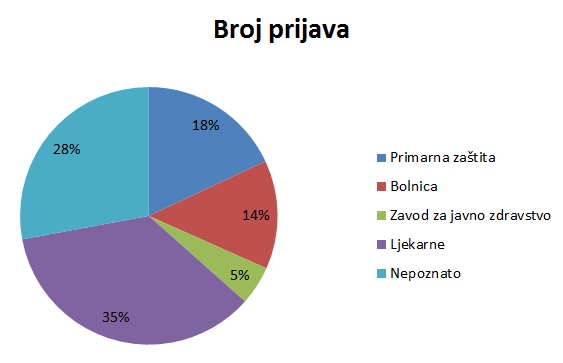
Slika 7. prikazuje udio pojedinih ustanova u prijavljivanju nuspojava. Pod kategorijom Primarna zdravstvena zaštita uključene su prijave zaprimljene iz ordinacija obiteljske medicine, ginekoloških i pedijatrijskih ordinacija, dok su kategorijom Bolnica obuhvaćene sve vrste bolnica i bolničkih centara. Posebno su izdvojeni zavodi za javno zdravstvo, koji su važni u sustavu prijavljivanja nuspojava cjepiva, te ljekarne. Ukupno 34% ustanova nije identificirano kroz prijavu, što je nešto više u odnosu na 2013. godinu. Tako visokom udjelu prijava bez ovih informacija najviše pridonose prijave od strane nositelja odobrenja, u kojima ova informacija u određenim slučajevima nedostaje zbog toga što elektronički sustavi pojedinih nositelja odobrenja ne prosljeđuju navedenu informaciju. HALMED radi na otklanjanju ovog problema jer značajno utječe na kvalitetu sustava i planiranje aktivnosti za njegovo unapređenje.
Tijekom 2014. godine putem on-line aplikacije za prijavu nuspojava dostupne na internetskim stranicama HALMED-a zaprimljeno je 335 prijava. Iako je navedena aplikacija namijenjena prvenstveno pacijentima, često je koriste i zdravstveni radnici; od 335 prijava zaprimljenih putem aplikacije, 254 su poslali zdravstveni radnici, a 81 pacijenti ili zakonski zastupnici/skrbnici. Do uspostavljanja zasebne on-line aplikacije, HALMED poziva zdravstvene radnike na korištenje trenutno dostupne aplikacije kako bi proces prijavljivanja sumnji na nuspojave bio što jednostavniji. Kontakt podatke prilikom slanja prijava putem ove aplikacije zdravstveni radnici mogu navesti u polju "Dodatni komentari".
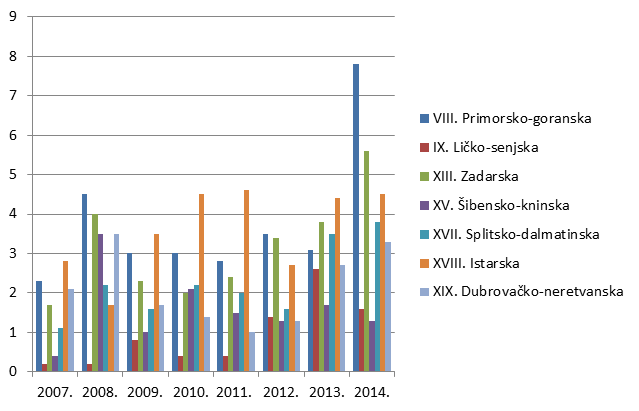
HALMED je i u 2014. godini iz svake županije zaprimio barem jednu prijavu sumnje na nuspojavu. Najviše prijava zaprimljeno je s područja Grada Zagreba - 1578. Slijede Primorsko-goranska s 233 prijava i Osječko-baranjska županija sa 192 prijave.
Tablica 6. Broj prijava nuspojava po županijama u 2014. godini
| Županija | Broj prijava u 2014. godini | Broj prijava na 10.000 stanovnika u 2014. godini |
|---|---|---|
| I. Zagrebačka | 120 | 3,8 |
| II. Krapinsko-zagorska | 50 | 3,8 |
| III. Sisačko-moslavačka | 104 | 6 |
| IV. Karlovačka | 27 | 2,1 |
| V. Varaždinska | 16 | 0,9 |
| VI. Koprivničko-križevačka | 80 | 7 |
| VII. Bjelovarsko-bilogorska | 70 | 5,8 |
| VIII. Primorsko-goranska | 233 | 7,8 |
| IX. Ličko-senjska | 8 | 1,6 |
| X. Virovitičko-podravska | 15 | 1,8 |
| XI. Požeško-slavonska | 11 | 1,4 |
| XII. Brodsko-posavska | 65 | 4,1 |
| XIII. Zadarska | 95 | 5,6 |
| XIV. Osječko-baranjska | 192 | 6,3 |
| XV. Šibensko-kninska | 14 | 1,3 |
| XVI. Vukovarsko-srijemska | 73 | 4,1 |
| XVII. Splitsko-dalmatinska | 171 | 3,8 |
| XVIII. Istarska | 94 | 4,5 |
| XIX. Dubrovačko-neretvanska | 39 | 3,3 |
| XX. Međimurska | 57 | 5,2 |
| XXI. Grad Zagreb | 1578 | 20 |
| UKUPNO | 3112 | 7,3 |
Prosječni broj prijava izražen na 10.000 stanovnika za cijelu Republiku Hrvatsku u 2014. godini iznosio je 7,3 prijava. U odnosu na prosjek Republike Hrvatske, Grad Zagreb i Primorsko-goranska županija bilježe iznadprosječni rezultat, Koprivničko-križevačka županija sasvim je blizu prosjeka, dok se sve druge županije nalaze ispod državnog prosjeka. U 16 županija zabilježen je porast prosječnog broja prijava izraženog na 10.000 stanovnika, u četirima županijama pad prosječnog broja prijava, a u jednoj je županiji prosječan broj prijava po stanovniku ostao isti u odnosu na 2013. godinu.
Razlog velikog broja prijava iz Grada Zagreba može se pronaći u činjenici da se sjedišta velikog broja nositelja odobrenja nalaze upravo u Zagrebu.
Na temelju ovih podataka HALMED će i dalje planirati održavanje radionica o ulozi zdravstvenih radnika u farmakovigilancijskom sustavu Republike Hrvatske.
Slika 8. Broj prijava na 10.000 stanovnika po županijama u razdoblju od 2007. do 2014. godine (kontinentalna Hrvatska)
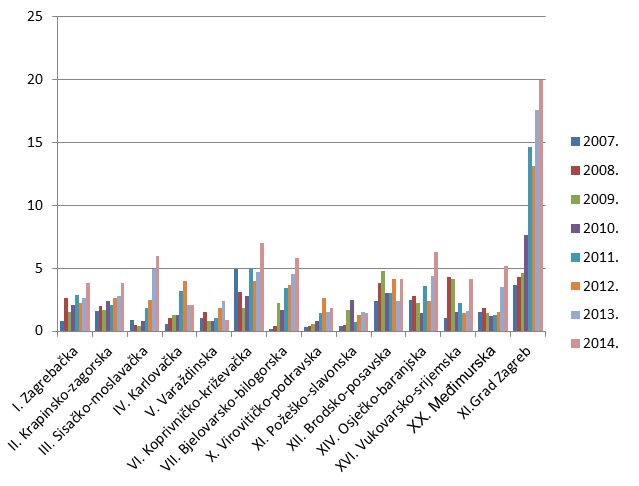
Slika 9. Broj prijava na 10.000 stanovnika po županijama u razdoblju od 2007. do 2014. godine (Jadranska Hrvatska)
2.2. Karakteristike prijava nuspojava lijekova i cjepiva
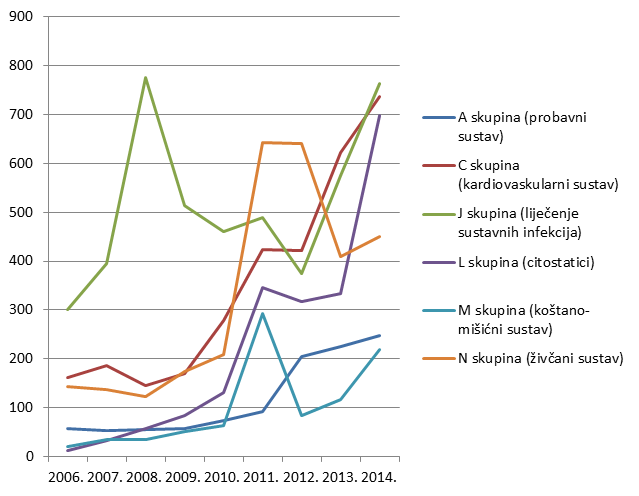
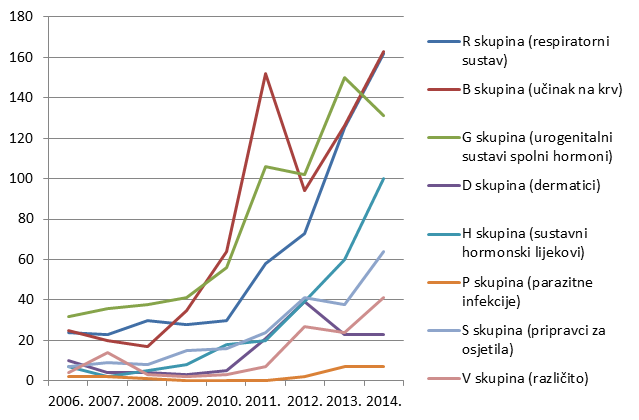
Po prvi put do sada u tri najzastupljenije skupine lijekova, pored skupina C (lijekovi za liječenje bolesti kardiovaskularnog sustava) i J (lijekovi za liječenje sustavnih infekcija i cjepiva), svrstala se i skupina L (citostatici). Rezultat je to povećanog napora u prijavljivanju kolega iz nekoliko bolničkih centara (prije svega kolega iz KBC Rijeka i KBC Sestre milosrdnice) koji su prepoznali važnost praćenja sigurnosti primjene lijekova. Važno je napomenuti kako povećan broj prijava za lijekove iz ove skupine nije utjecao na omjer koristi i rizika niti za jedan pojedinačni lijek iz L skupine. Ukupni broj lijekova za koje je prijavljena sumnja na nuspojavu veći je od ukupnog broja prijava jer u jednoj prijavi sumnje na nupojavu može biti više od jednog lijeka pod sumnjom (Tablica 7.).
Tablica 7. Apsolutni broj lijekova za koje je u 2014. godini prijavljena sumnja na nuspojavu prema Anatomsko-Terapijsko-Kemijskoj (ATK) klasifikaciji
| ATK klasifikacija | 2014. |
|---|---|
| ATK 1. razina A skupina (probavni sustav) | 248 |
| ATK 1. razina B skupina (učinak na krv) | 163 |
| ATK 1. razina C skupina (kardiovaskularni sustav) | 737 |
| ATK 1. razina D skupina (dermatici) | 23 |
| ATK 1. razina G skupina (urogenitalni sustav i spolni hormoni) | 131 |
| ATK 1. razina H skupina (sustavni hormonski lijekovi) | 100 |
| ATK 1. razina J skupina (liječenje sustavnih infekcija) | 763 |
| ATK 1. razina L skupina (citostatici) | 698 |
| ATK 1. razina M skupina (koštano-mišićni sustav) | 219 |
| ATK 1. razina N skupina (živčani sustav) | 451 |
| ATK 1. razina P skupina (parazitne infekcije) | 7 |
| ATK 1. razina R skupina (respiratorni sustav) | 162 |
| ATK 1. razina S skupina (pripravci za osjetila) | 64 |
| ATK 1. razina V skupina (različito) | 41 |
| UKUPNI BROJ LIJEKOVA | 3807 |
Slika 10. Broj prijava na 10.000 stanovnika po županijama u razdoblju od 2007. do 2014. godine (kontinentalna Hrvatska)
Slika 11. Broj prijava na 10.000 stanovnika po županijama u razdoblju od 2007. do 2014. godine (kontinentalna Hrvatska)
Tablica 8. Broj prijava po ATK skupinama lijekova i prijaviteljima u 2014. godini
| Mjesto po broju prijava po ATK skupinama | Liječnici | Farmaceuti | Pacijenti | |||
|---|---|---|---|---|---|---|
| Skupina | Broj prijava | Skupina | Broj prijava | Skupina | Broj prijava | |
| 1. | L | 636 | C | 438 | J | 63 |
| 2. | J | 479 | J | 191 | C | 27 |
| 3. | C | 260 | N | 173 | G | 20 |
Liječnici najčešće prijavljuju nuspojave za lijekove iz ATK skupine L (citostatici), dok farmaceuti najčešće prijavljuju nuspojave za lijekove iz ATK skupine C (lijekovi za liječenje bolesti srca i krvnih žila). Zanimljivo je da u tri najzastupljene skupine lijekova za čije nuspojave najviše prijava stiže od pacijenata svrstala skupina G (lijekovi za liječenje urogenitalnog sustava i spolni hormoni).
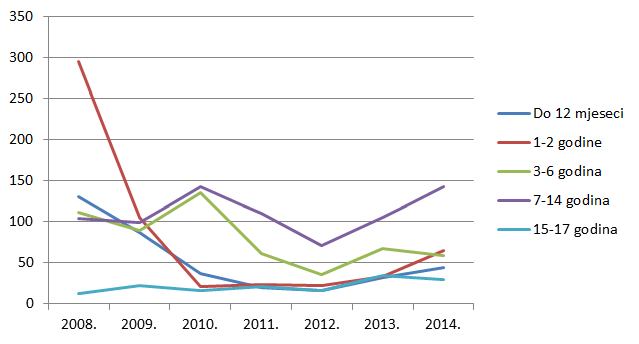
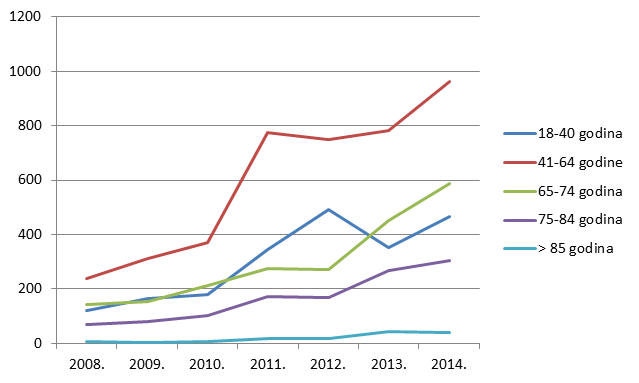
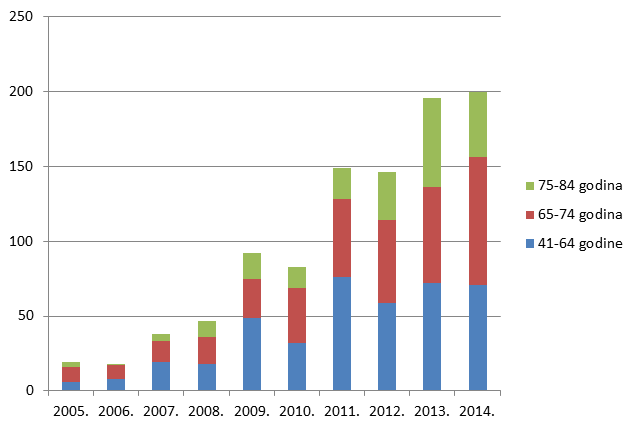
Kako pokazuje Tablica 9., ukupan broj prijava sumnji na nuspojave u mlađim dobnim kategorijama blago je porastao, ponovno kao funkcija općenitog porasta broja prijava sumnji na nuspojave cjepiva. I dalje bilježimo izrazit porast broja prijava sumnji na nuspojave u starijim dobnim skupinama uz stagnaciju u onoj najstarijoj (više od 85 godina).
Tablica 9. Prijave sumnji na nuspojave lijekova prema dobi bolesnika u 2014. godini u usporedbi s 2013. godinom
| Dob bolesnika | Broj prijava u 2014. godini | Broj prijava u 2013. godini |
|---|---|---|
| Do 12 mjeseci | 44 | 32 |
| 1 do 2 godine | 65 | 34 |
| 3 do 6 godina | 59 | 67 |
| 7 do 14 godina | 143 | 105 |
| 15 do 17 godina | 30 | 35 |
| 18 do 40 godina | 465 | 352 |
| 41 do 64 godine | 963 | 781 |
| 65 do 74 godina | 589 | 451 |
| 75 do 84 godina | 304 | 269 |
| 85 godina i starije | 41 | 44 |
| Neupisana dob | 409 | 321 |
| UKUPNO | 3112 | 2491 |
Ukupno gledajući, sumnje na nuspojave u 2014. godini prijavljivane su za bitno stariju populaciju u odnosu na onu iz 2013. godine. Broj prijava iz kojih nije bilo moguće saznati točnu dob pacijenta iznosio je 13%, jednako kao i 2013. godine, pa je u ovom segmentu ostalo još prostora za povećavanje kvalitete prijava koje HALMED zaprima.
Slika 12. Pregled kretanja broja prijava za mlađe dobne kategorije u razdoblju od 2008. do 2014. godine
Slika 13. Pregled kretanja broja prijava za punoljetne osobe u razdoblju od 2008. do 2014. godine
Tablica 10. Prijave sumnji na nuspojave prema spolu bolesnika (usporedba s podacima iz 2013. godine)
| Spol | Broj prijava u 2014. godini | Broj prijava u 2013. godini | % u 2014. godini | % u 2013. godini |
|---|---|---|---|---|
| Muškarci | 1118 | 945 | 36 | 38 |
| Žene | 1860 | 1462 | 60 | 59 |
| Nepoznato | 134 | 84 | 4 | 3 |
| UKUPNO | 3112 | 2491 | 100 | 100 |
Slika 14. Prijave sumnji na nuspojave po spolu bolesnika u 2014. godini
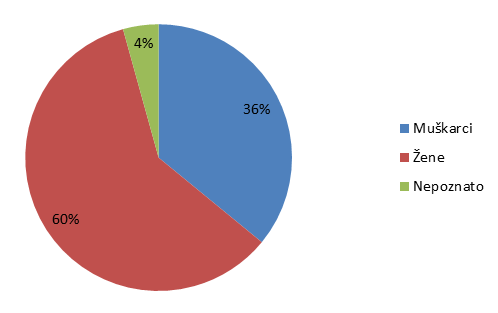
Statistika koju HALMED vodi za sumnje na nuspojave lijekova već desetu godinu zaredom pokazuje da je veći broj prijava sumnji na nuspojavu zaprimljen za bolesnike ženskog spola.
Nuspojave se osnovno dijele na nuspojave tipa A (posljedica pretjeranog farmakološkog učinka) i nuspojave tipa B, koje uključuju imunoalergijske reakcije, pseudoalergijske reakcije, metaboličku intoleranciju i idiosinkrazije. Od ukupno 8208 prijavljenih nuspojava, u 2216 slučajeva može se govoriti o reakcijama tipa B, što čini 27,08% svih nuspojava, a što je usporedivo s 2013. godinom.
U uzorku iz 2014. godine među osobama kod kojih se javljaju nuspojave tipa B dominiraju osobe ženskog spola. U 3% prijava spol nije poznat (Tablica 12.).
Broj prijava sumnji na nedjelotvornost lijekova (tip F) u 2014. godini iznosio je 0,80% ukupnog broja prijava.
Tablica 11. Vrste prijavljenih nuspojava u 2014. godini u usporedbi s podacima iz 2013. godine
| Vrsta nuspojava | Broj nuspojava u 2014. godini | Broj nuspojava u 2013. godini | % nuspojava u 2014. godini | % nuspojava u 2013. godini |
|---|---|---|---|---|
| Tip A | 5910 | 4632 | 72,12 | 69 |
| Tip B | 2216 | 1973 | 27,08 | 29 |
| Tip F | 82 | 134 | 0,80 | 2 |
| UKUPNO | 8208 | 6739 | 100 | 100 |
Tablica 12. Odnos spola i reakcija tipa B u 2014. godini u usporedbi s podacima iz 2013. i 2012. godine
| Spol | Broj nuspojava tipa B u 2014. (2013.) (2012.) godini | % u 2014. (2013.) (2012.) godini |
|---|---|---|
| Muškarci | 598 (629) (216) | 27 (32) (30) |
| Žene | 1551 (1301) (482) | 70 (66) (67) |
| Nepoznato | 67 (43) (20) | 3 (2) (3) |
| UKUPNO | 2216 (1973) (718) | 100 |
Slika 15. Udio nuspojava tipa B po spolu bolesnika/korisnika lijekova u razdoblju od 2005. do 2014. godine
Kada govorimo o nuspojavama tipa A, koje su posljedica pretjeranoga farmakološkog učinka, vrijedi istaknuti da su tijekom 2014. godine, kao i prethodnih godina, putem projekta "Farmakogenomika i farmakovigilancija - sprečavanje nuspojava u individualizaciji terapije", u Kliničkoj jedinici za farmakogenomiku i individualizaciju terapije Kliničkog bolničkog centra Zagreb provedene različite farmakogenetičke analize za pacijente koji su razvili nuspojavu na neki lijek koja je prijavljena HALMED-u. Rezultati genetičkih analiza koriste se za individualizaciju terapije pojedinačnog pacijenta. Također, koriste se u svrhu rada na području farmakovigilancije, a mogu poslužiti i pri otkrivanju novih sigurnosnih signala.
Popis lijekova, nuspojava i farmakogenetičkih biljega analiziranih u sklopu suradnje HALMED-a i KBC-a Zagreb naveden je u Tablica 13.
Tablica 13. Popis lijekova, nuspojava i farmakogenetičkih biljega analiziranih u sklopu suradnje HALMED-a i KBC-a Zagreb
| Skupina lijekova/ lijek | Nuspojave | Ukupno |
|---|---|---|
| statini simvastatin atorvastatin |
miotoksičnost, hepatotoksičnost | SLCO1B1, ABCG2, MDR1 |
| statini rosuvastatin fluvastatin |
miotoksičnost, hepatotoksičnost | CYP2C9, CYP2C19 SLCO1B1, ABCG2, MDR1 |
| varfarin | manja i veća krvarenja | CYP2C9, VKORC1, MDR1 |
| klopidogrel | manja i veća krvarenja | CYP2C19, CYP3A4, MDR1 |
| dabigatran rivaroksaban | manja i veća krvarenja | ABCB1 CYP3A4 |
| antiepileptici | hepatotoksičnost, tremor, glavobolja, vrtoglavica | CYP2C9, CYP2C19, CYP3A4, UGT2B7, ABCC2 |
| antipsihotici | akutni ekstrapiramidni simptomi, parkinsonizam, akatizija | CYP2D6, CYP3A4, DAT, D2R |
| imunosupresivi ciklosporin, takrolimus mikofenolna kiselina |
nefrotoksičnost, gastrointestinalna nepodnošljivost, mijelosupresija | CYP3A4/5, MDR1, MRP2 |
| 5-FU, irinotekan | mijelosupresija, proljev, smrt | DPYD, UGT1A1, SLCO1B1 |
| metotreksat | nefrotoksičnost | ABCB1, ABCC2, ABCG2, SLCO1B1 |
| azatioprin | mijelosupresija, simptomi slični gripi, hepatotoksičnost | TPMT, ITPA, XO |
| inhibitori tirozin kinaze | pankreatitis, rabdomioliza, glavobolja, osip, crvenilo i svrbež kože | CYP2D6, CYP2C9, CYP3A4, ABCB1 |
| nesteroidni antireumatici | mučnina, gastrointestinalna nepodnošljivost, hepatotoksičnost, manja i veća krvarenja | CYP2C9, CYP2C19, ABCC2 |
2.2.4. Broj lijekova u istovremenoj primjeni
Što se tiče odnosa dobi bolesnika i broja lijekova koje bolesnik istovremeno primjenjuje, u 2014. godini veći broj prijava sumnji na nuspojave cjepiva nije promijenio očekivanu sliku primjene lijekova u mlađih dobnih skupina gdje prevladava primjena samo jednog lijeka u terapiji odnosno prevenciji bolesti. Održan je trend prijava primjene većeg broja istodobno primijenjenih lijekova, posebno u starijim dobnim skupinama, što može biti objašnjenje većeg apsolutnog broja nuspojava zabilježenog u 2014. godini iako su ukupno one bile manje ozbiljne, kao što je objašnjeno u daljnjem tekstu (Tablica 14.).
Tablica 14. Dob bolesnika i broj lijekova koje bolesnik istovremeno primjenjuje
| Dob | 1 lijek | 2-3 lijeka | 4-5 lijekova | > 5 lijekova | Ukupno |
|---|---|---|---|---|---|
| Do 12 mjeseci | 36 | 7 | 0 | 1 | 44 |
| 1-2 godine | 57 | 8 | 0 | 0 | 65 |
| 3-6 godina | 51 | 7 | 1 | 0 | 59 |
| 7-14 godina | 111 | 30 | 2 | 0 | 143 |
| 15-17 godina | 21 | 9 | 0 | 0 | 30 |
| 18-40 godina | 273 | 147 | 36 | 9 | 465 |
| 41-64 godine | 402 | 300 | 190 | 71 | 963 |
| 65-74 godina | 160 | 172 | 172 | 85 | 589 |
| 75-84 godina | 75 | 78 | 107 | 44 | 304 |
| > 85 godina | 10 | 8 | 12 | 11 | 41 |
| Neupisano | 197 | 83 | 62 | 67 | 409 |
| UKUPNO | 1393 | 849 | 469 | 288 | 3112 |
Slika 16. Udio prijava s 2-3 lijeka u istovremenoj primjeni po dobnim skupinama u odrasloj dobi u razdoblju od 2005. do 2014. godine
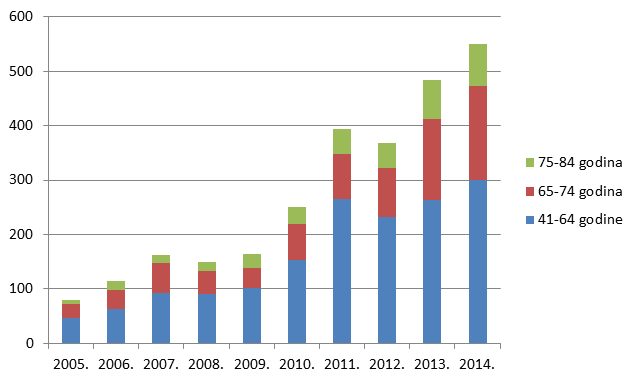
Slika 17. Udio prijava s 4-5 lijekova u istovremenoj primjeni po dobnim skupinama u odrasloj dobi u razdoblju od 2005. do 2014. godine
Slika 18. Udio prijava s više od 5 lijekova u istovremenoj primjeni po dobnim skupinama u odrasloj dobi u razdoblju od 2005. do 2014. godine
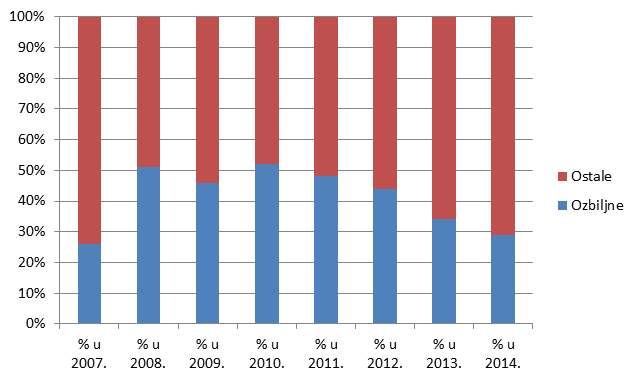
U 2014. godini broj nuspojava koje ne ispunjavaju niti jedan od kriterija za ozbiljnu nuspojavu značajno je veći od broja onih koji takve kriterije ispunjavaju (71% ne-ozbiljnih prema 29% ozbiljnih nuspojava).
Nuspojave koje zadovoljavaju najmanje jedan od navedenih kriterija smatraju se u regulatornom smislu ozbiljnima:
- ako se radi o medicinski značajnom stanju koje se može smatrati ozbiljnim
- ako je nuspojava uzrokovala hospitalizaciju (bolničko liječenje) ili produženje hospitalizacije
- ako je došlo do razvoja anomalije kod novorođenčeta zbog toga što je majka uzimala lijek tijekom trudnoće
- ako je nuspojava izazvala invalidnost ili trajnu nesposobnost
- ako nuspojava ugrožava život bolesnika/korisnika lijeka
- ako je nuspojava izazvala smrt osobe.
Razlozi za općenito niži udio ozbiljnih nuspojava među prijavljenim nuspojavama mogu se pronaći u sve većem broju prijava od strane farmaceuta te manjem broju prijava koje pristižu iz bolničkih centara.
Kao što se može vidjeti iz Tablice 15., broj prijava sumnji da je nuspojava određenog lijeka uzrokovala smrtni slučaj u 2014. godini niži je u odnosu na ranije godine, što je izvrstan podatak gledajući ga u kontekstu snažnog porasta broja prijava sumnji na nuspojave na godišnjoj razini a što sve ide u prilog činjenici da su lijekovi na tržištu RH iznimno sigurni.
Slika 19. Kretanje broja prijava prema ozbiljnosti u razdoblju od 2007. do 2014. godine
Tablica 15. Broj ozbiljnih nuspojava prijavljenih u 2014. godini u usporedbi s 2013. godinom sukladno kriterijima prema ICH smjernici E2A
| Kriterij | Broj prijava u 2014. godini | Broj prijava u 2013. godini |
|---|---|---|
| Smrt | 28 | 32 |
| Hospitalizacija | 376 | 275 |
| Invalidnost | 11 | 33 |
| Ugrožava život | 75 | 76 |
| Prirođena anomalija | 0 | 2 |
| Medicinski značajno ozbiljno stanje | 569 | 568 |
| UKUPNO | 1059* | 986 |
*neke nuspojave ispunjavaju nekoliko kriterija ozbiljnosti pa je ukupan zbroj u tablici veći od ukupnog broja prijava ozbiljnih nuspojava
Tablica 16. Pregled ozbiljnih prijava prema tipu prijavitelja
| Kriterij | Liječnici | Farmaceuti | Pacijenti / korisnici / skrbnici | Ostali zdravstveni radnici |
|---|---|---|---|---|
| Broj ozbiljnih prijava | 679 (41%) | 130 (11%) | 49 (26%) | 56 (56%) |
| Ukupan prijava iz izvora | 1665 | 1159 | 187 | 100 |
| Udio u ukupnom broju ozbiljnih nuspojava | 74% | 14% | 5% | 6% |
U Tablici 16. vidljivo je da se u 41% prijava od strane liječnika radi o ozbiljnim prijavama, dok je u skupini ostalih zdravstvenih radnika prijavljeno čak 56% nuspojava koje su ocijenjene kao ozbiljne. Statističkom analizom predstavljenom kroz tri tablice u nastavku Izvješća testirana su četiri različita para prijavitelja kako bi se stekao bolji uvid u obrasce prijavljivanja ozbiljnih nuspojava pojedinih kategorija prijavitelja. Može se zaključiti da farmaceuti statistički značajno manje prijavljuju ozbiljne nuspojave u usporedbi s liječnicima i pacijentima. Liječnici u prošlogodišnjem uzorku statistički značajno češće prijavljuju ozbiljne nuspojave od pacijenata za razliku od uzorka iz 2013. godine. Zanimljiva je i razlika u prijavljivanju ozbiljnih nuspojava između dvije podskupine prijava u kojima su prijavitelji pacijenti: podskupina pacijenata kod kojih je pošiljatelj bio nositelj odobrenja statistički značajno manje prijavljuju ozbiljne nuspojave od podskupine koji direktno šalju prijave HALMED-u.
Tablica 17. Liječnici - ljekarnici (Hi-kvadrat test)
| Vrijednost | Statistička značajnost | |
|---|---|---|
| Pearsonov Hi-kvadrat test | 291,844a | p < 0,000* |
Tablica 18. Ljekarnici - pacijenti (Hi-kvadrat test)
| Vrijednost | Statistička značajnost | |
|---|---|---|
| Pearsonov Hi-kvadrat test | 31,366 | p < 0,000 |
Tablica 19. Liječnici - pacijenti (Hi-kvadrat test)
| Vrijednost | Statistička značajnost | |
|---|---|---|
| Pearsonov Hi-kvadrat test | 15,292 | 0,000 |
Tablica 20. Pacijenti - pacijenti (Hi-kvadrat test)
| Vrijednost | Statistička značajnost | |
|---|---|---|
| Pearsonov Hi-kvadrat test | 17,209 | 0,007 |
U 2014. godini povećan je postotak pacijenata koji se potpuno oporave nakon razvoja nuspojave lijeka, a također se smanjio broj prijava koje nemaju podatke o ishodu nuspojave, što je svakako kvalitativni korak naprijed (Tablica 21). HALMED će putem dodatnih edukativnih aktivnosti pokušati dodatno poboljšati ovaj pokazatelj kvalitete prijava jer je 28% prijava bez informacije o ishodu nuspojave još uvijek neprihvatljivo visok udio.
Sumnja da je smrtni ishod nastao kao posljedica nuspojave lijeka prijavljena je u 28 slučajeva. U najvećem broju smrtnih slučajeva za koje se sumnja da su povezani s lijekovima radi o bolesnicima s teškom osnovnom bolešću, što dodatno otežava procjenu povezanosti lijeka i nuspojave sa smrtnim ishodom.
Zanimljivo je da je od 28 prijava sa smrtnim ishodom tek jedna od njih prijavljena od strane pacijenata, dok su ostale prijavljene od strane zdravstvenih radnika.
Tablica 21. Udio nuspojava lijekova i cjepiva prijavljenih u 2014. godini s ishodom nuspojava u usporedbi s 2013. godinom
| Ishod nuspojave | 2014. | 2013. | % 2014. | % 2013. |
|---|---|---|---|---|
| Oporavak bez posljedica | 4558 | 3678 | 58 | 55 |
| Oporavak s posljedicama | 88 | 50 | 1 | 1 |
| U tijeku | 994 | 521 | 13 | 8 |
| Bez oporavka / Nepoznato | 2221 | 2420 | 28 | 36 |
2.2.7. Nuspojave po organskim sustavima
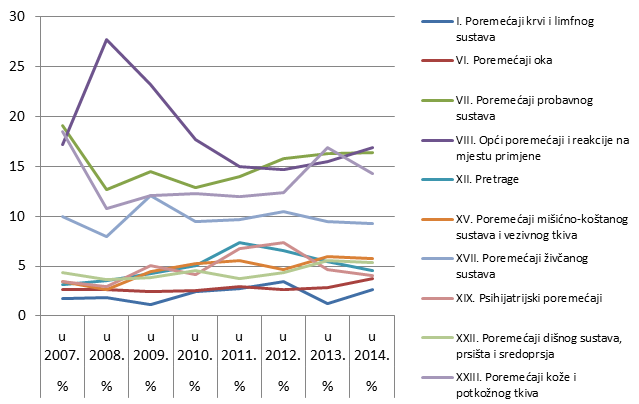
Nuspojave su navedene prema MedDRA-inoj klasifikaciji organskih sustava (MedDRA, Medical Dictionary for Regulatory Activities - Medicinski rječnik za regulatorne poslove), koja se koristi u kodiranju prijavljenih nuspojava i standard je za međunarodnu komunikaciju na tom području. Najveći broj nuspojava zabilježen je za organski sustav (SOC) Opći poremećaji i reakcije na mjestu primjene (16,9), potom za SOC Poremećaji probavnog sustava (16,4) te za SOC Poremećaji kože i potkožnog tkiva (14,3).
Tablica 22. Nuspojave prema MedDRA-inoj klasifikaciji organskih sustava u 2014. godini
| Organski sustav (SOC) | Broj nuspojava u 2014. godini | Udio nuspojava u 2014. godini (%) |
|---|---|---|
| I. Poremećaji krvi i limfnog sustava | 224 | 2,7 |
| II. Srčani poremećaji | 139 | 1,7 |
| III. Prirođeni, obiteljski i genetski poremećaji | 1 | 0,0 |
| IV. Poremećaji uha i labirinta | 145 | 1,8 |
| V. Endokrini poremećaji | 15 | 0,2 |
| VI. Poremećaji oka | 311 | 3,8 |
| VII. Poremećaji probavnog sustava | 1345 | 16,4 |
| VIII. Opći poremećaji i reakcije na mjestu primjene | 1390 | 16,9 |
| IX. Poremećaji jetre i žuči | 56 | 0,7 |
| X. Poremećaji imunološkog sustava | 93 | 1,1 |
| XI. Infekcije i infestacije | 180 | 2,2 |
| XII. Pretrage | 379 | 4,6 |
| XII. Ozljede, trovanja i proceduralne komplikacije | 122 | 1,5 |
| XIV. Poremećaji metabolizma i prehrane | 103 | 1,3 |
| XV. Poremećaji mišićno-koštanog sustava i vezivnog tkiva | 478 | 5,8 |
| XVI. Dobroćudne, zloćudne i nespecificirane novotvorine | 27 | 0,3 |
| XVII. Poremećaji živčanog sustava | 763 | 9,3 |
| XVIII. Stanja vezana uz trudnoću, babinje i perinatalno razdoblje | 15 | 0,2 |
| XIX. Psihijatrijski poremećaji | 337 | 4,1 |
| XX. Poremećaji bubrega i mokraćnog sustava | 103 | 1,3 |
| XXI. Poremećaji reproduktivnog sustava i dojki | 117 | 1,4 |
| XXII. Poremećaji dišnog sustava, prsišta i sredoprsja | 443 | 5,4 |
| XXIII. Poremećaji kože i potkožnog tkiva | 1177 | 14,3 |
| XXIV. Socijalne okolnosti | 18 | 0,2 |
| XXV. Operativni i medicinski postupci | 36 | 0,4 |
| XXVI. Krvožilni poremećaji | 191 | 2,3 |
| UKUPNO | 8208 | 100,0 |
Slika 20. Prikaz kretanja nuspojava iz najzastupljenijih organskih sustava u razdoblju od 2007. do 2014. godine
Tablica 23. Ukupni broj prijava klasificiranih prema organskim sustavima (SOC) po prijaviteljima u 2014. godini
| Mjesto po broju prijava po SOC-u | Liječnici | Farmaceuti | Pacijenti | |||
|---|---|---|---|---|---|---|
| SOC | Broj prijava | SOC | Broj prijava | SOC | Broj prijava | |
| 1. | VIII | 840 | VII | 632 | VIII | 129 |
| 2. | XXIII | 619 | XXIII | 471 | VII | 94 |
| 3. | VII | 601 | VIII | 363 | XVII | 71 |
Zanimljivo je promotriti za koje organske sustave stiže najviše prijava od strane liječnika, farmaceuta i pacijenata; liječnici su u 2014. godini najčešće prijavljivali nuspojave svrstane u SOC VIII. Opći poremećaji i reakcije na mjestu primjene. Kod liječnika su na drugom mjestu nuspojave iz SOC-a XXIII. Poremećaji kože i potkožnog tkiva, a na trećem mjestu SOC VII. Poremećaji probavnog sustava.
Farmaceuti su u 2014. godini najčešće prijavljivali nuspojave iz SOC-a VII. Poremećaji probavnog sustava, na drugom mjestu su nuspojave iz SOC-a XXIII. Poremećaji kože i potkožnog tkiva, dok su na trećem mjestu nuspojave iz SOC-a VIII. Opći poremećaji i reakcije na mjestu primjene. Pacijenti, kao i liječnici, najčešće prijavljuju nuspojave iz SOC-a VIII. Opći poremećaji i reakcije na mjestu primjene. Na drugom mjestu prema zastupljenosti među prijavama pacijenata nalaze se nuspojave iz SOC-a VII. Poremećaji probavnog sustava. Za razliku od prijava zdravstvenih radnika, među tri najzastupljenija SOC-a u prijavama pacijenata nalazi se i SOC XVII. Poremećaji živčanog sustava. Izravne prijave pacijenata na taj način pridonose boljoj obuhvatnosti svih nuspojava koje utječu na kvalitetu života pojedinaca, što je potrebno uzeti u obzir prilikom detekcije i obrade novih sigurnosnih signala.
2.2.8. Najčešće prijavljene nuspojave u 2014. godini
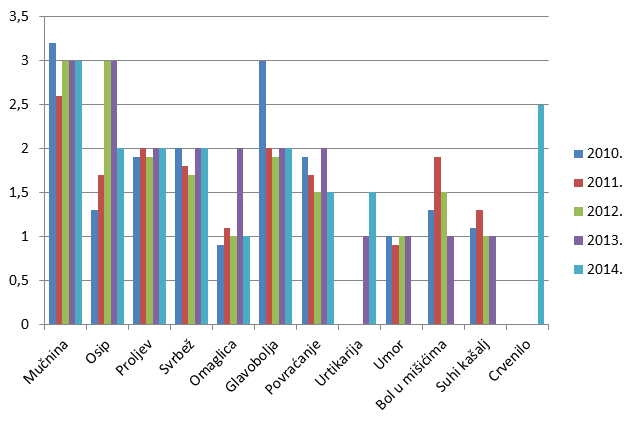
Kao i u prošlogodišnjem Izvješću, donosimo pregled najčešće prijavljenih nuspojava. U tablici su navedene samo one nuspojave koje su prijavljene više od 100 puta. U 2014. godini najčešće su prijavljene nuspojave kao što su mučnina, crvenilo, svrbež i osip, što su nuspojave karakteristične za klasične sintetske lijekove. Riječ je o nuspojavama koje su prijaviteljima dobro uočljive, jasno vremenski povezane s uzimanjem lijeka (najčešće nestaju nakon prestanka uzimanja lijeka) te nerijetko značajno smanjuju kvalitetu života pacijenta iako regulatorno ne spadaju u ozbiljne nuspojave. S druge strane, u praksi dio simptoma ne biva prepoznat kao nuspojava lijeka već se dijagnosticira kao "nova bolest" (hipertenzija, kardiovaskularni incidenti, prijelom kostiju, razvoj depresije). Najčešće se radi o nuspojavama koje se javljaju kod dugotrajne primjene lijeka ili kombinacije lijekova pa izostaje jasna vremenska povezanost. Kod takvih primjera nuspojava primjenjuju se druge strategije utvrđivanja eventualne povezanosti lijeka i nuspojave kao što su farmakoepidemiološke studije.
Tablica 24. Najčešće prijavljene nuspojave u 2014. godini
| Nuspojava | Broj prijava u 2014. godini |
|---|---|
| Mučnina | 255 |
| Crvenilo (Eritem) | 204 |
| Svrbež | 187 |
| Glavobolja | 186 |
| Osip | 163 |
| Proljev | 163 |
| Kašalj | 134 |
| Slabost | 126 |
| Urtikarija | 124 |
| Povraćanje | 120 |
| Vrtoglavica | 102 |
| Bol u trbuhu | 102 |
Slika 21. Grafički prikaz udjela najčešće prijavljenih nuspojava u odnosu na ukupan broj prijavljenih nuspojava u razdoblju od 2010. do 2014. godine
3. Pregled sigurnosnih pitanja u 2014. godini
3.1. Pregled najvažnijih sigurnosnih regulatornih mjera poduzetih u 2014. godini
3.1.1. Lijekovi koji sadrže valproat i srodne tvari
Tijekom 2014. godine na razini Europske unije provedena je ocjena lijekova koji sadrže valproat i srodne tvari (odnosi se na natrijev valproat, valproatnu kiselinu, fiksnu kombinaciju natrijevog valproata/valproatne kiseline i valpromid). Ocjena se odnosila na primjenu ovih lijekova u trudnica, a započeta je zbog zabrinutosti oko rizika od urođenih anomalija i problema u razvoju u djece koja su valproatu bila izložena u maternici tijekom trudnoće majke.
Valproat se koristi u liječenju epilepsije i bipolarnog poremećaja. U nekoliko zemalja EU, u koje se ne ubraja Republika Hrvatska, valproat se primjenjuje i za sprečavanje migrene. Nakon provedene ocjene, zaključeno je da je zbog navedenih rizika potrebno uvesti stroža ograničenja primjene valproata u žena i djevojaka. Specifično, preporučeno je da se valproat ne primjenjuje u liječenju epilepsije ili bipolarnog poremećaja u djevojaka ili žena koje bi mogle ostati trudne kao i u žena koje već jesu trudne, osim u slučaju kada su drugi lijekovi neučinkoviti ili ih pacijentica ne podnosi.
U ovu su ocjenu aktivno bili uključeni predstavnici udruga bolesnika te njihovih skrbnika i obitelji. Bolesnici su bili u mogućnosti razmijeniti svoja mišljenja, uključujući i stajališta o tome kako najbolje informirati i podići razinu svijesti među pacijentima, njihovim obiteljima te relevantnim grupama zdravstvenih radnika.
Zbog navedenog sigurnosnog pitanja upućeno je pismo zdravstvenim radnicima, javnost je informirana putem internetskih stranica HALMED-a te su izmijenjeni sažeci opisa svojstava lijeka i upute o lijeku odgovarajućih lijekova kako bi se uvrstila navedena ograničenja primjene i ostale nove informacije. Zbog navedenih rizika nositeljiima odobrenja uvedena je i obveza da za zdravstvene radnike i bolesnice izrade edukacijske materijale u svrhu informiranja o rizicima povezanima s primjenom valproata u djece ženskog spola, žena u reproduktivnoj dobi i trudnica. Dodatno je na razini EU uvedena obveza za nositelje odobrenja da provedu ispitivanje potrošnje lijeka (engl. drug utilisation study) kako bi se ocijenila učinkovitost mjera minimizacije rizika i bolje istražila propisivačka praksa za ove lijekove.
3.1.2. Lijekovi koji sadrže bromokriptin
Tijekom 2014. godine na razini Europske unije provedena je ocjena lijekova čija je djelatna tvar bromokriptin zbog zabrinutosti oko rizika od potencijalno ozbiljnih kardiovaskularnih, neuroloških i psihijatrijskih nuspojava.
Ocjena se odnosila na primjenu ovih lijekova za sprečavanje postpartalne laktacije (stvaranja mlijeka u žena nakon poroda).
Nakon provedene ocjene, zaključeno je da je zbog navedenih rizika potrebno uvesti dodatna ograničenja primjene ovih lijekova. Ocijenjeno je da se povezanost bromokriptina s rijetkim, ali potencijalno ozbiljnim kardiovaskularnim, neurološkim i psihijatrijskim nuspojavama ne može isključiti. Stoga je zaključeno da se ovi lijekovi smiju primjenjivati u sprečavanju postpartalne laktacije samo ako postoje uvjerljivi medicinski razlozi za sprečavanje laktacije, kao što je izbjegavanje dodatne patnje za majku zbog gubitka djeteta tijekom ili neposredno nakon poroda, ili u majki s HIV infekcijom, koje ne bi smjele dojiti. Bromokriptin se ne bi trebao rutinski primjenjivati za sprečavanje ili zaustavljanje stvaranja mlijeka, niti za olakšavanje simptoma boli ili oticanja dojki nakon poroda. Također je zaključeno da se bromokriptin ne smije primjenjivati u žena koje su pod povećanim rizikom od nastanka nuspojava, uključujući žene koje imaju poremećaje koji dovode do povišenja krvnog tlaka ili koje imaju teške psihijatrijske poremećaje.
Zbog navedenog sigurnosnog pitanja javnost je informirana putem internetskih stranica HALMED-a te su izmijenjeni sažeci opisa svojstava lijeka i upute o lijeku odgovarajućih lijekova kako bi se uvrstile gore navedene informacije.
3.1.3. Lijekovi koji djeluju na renin-angiotenzinski sustav
Tijekom 2014. godine na razini Europske unije provedena je ocjena lijekova koji djeluju na renin-angiotenzinski sustav zbog zabrinutosti oko rizika istodobne primjene dvaju lijekova iz različitih razreda ove terapijske skupine.
Renin-angiotenski sustav (RAS) je hormonski sustav koji regulira krvni tlak i volumen tekućine u tijelu. Lijekovi koji djeluju na RAS koriste se prvenstveno u liječenju hipertenzije (povišenog krvnog tlaka) i kongestivnog zatajenja srca (srčane bolesti pri kojoj srce ne opskrbljuje tijelo dovoljnom količinom krvi). Ovi lijekovi pripadaju trima glavnim skupinama: inhibitori angiotenzin konvertirajućeg enzima (tzv. ACE inhibitori) poput benazeprila, kaptoprila, cilazaprila, delaprila, enalaprila, fosinoprila, imidaprila, lisinoprila, moeksiprila, perindoprila, kvinaprila, ramiprila, spiraprila, trandolaprila i zofenoprila; blokatori angiotenzinskih receptora (tzv. sartani ili ARB-i) poput kandesartana, telmisartana, valsartana, irbesartana, eprosartana, olmesartana, losartana i azilsartana; te izravni inhibitori renina, poput aliskirena.
Kombinacija dvaju lijekova koji djeluju na RAS povremeno se koristi kako bi se postigao bolji terapijski učinak. Međutim, najnoviji dokazi ukazuju na to da takva kombinacija u većine bolesnika ne donosi dodatne koristi, a može povećati rizik od hipotenzije (sniženog krvnog tlaka), povišenja kalija u krvi i oštećenja bubrega (uključujući akutno zatajenje bubrega). Stoga je nakon provedene ocjene zaključeno da se više ne preporučuje dvostruka blokada RAS sustava, odnosno istodobna primjena ACE inhibitora, blokatora angiotenzinskih receptora ili aliskirena. Nadalje, u bolesnika koji zbog dijabetesa imaju tegobe sa bubrezima istodobna primjena ACE inhibitora i blokatora angiotenzinskih receptora se ne preporučuje, dok je istodobna primjena aliskirena i ACE inhibitora ili blokatora angiotenzinskih receptora od ranije kontraindicirana u bolesnika koji boluju od dijabetesa ili bolesti bubrega.
Postoji mogućnost da će kombinirana primjena ovih lijekova i dalje biti potrebna u manjeg dijela bolesnika, prvenstveno onih koji boluju od zatajenja srca. Ako se terapija dvostrukom blokadom smatra apsolutno nužnom, smije se provoditi samo pod nadzorom specijalista i uz pažljivo praćenje bubrežne funkcije, elektrolita i krvnog tlaka.
Zbog navedenog sigurnosnog pitanja javnost je informirana putem internetskih stranica HALMED-a te su izmijenjeni sažeci opisa svojstava lijeka i upute o lijeku odgovarajućih lijekova kako bi se uvrstile gore navedene informacije.
3.1.4. Lijekovi koji sadrže testosteron
Tijekom 2014. godine na razini Europske unije provedena je ocjena lijekova koji sadrže testosteron zbog zabrinutosti oko kardijalnih (srčanih) nuspojava ovih lijekova, uključujući srčani udar.
Navedeni lijekovi uglavnom se koriste u muškaraca u kojih se ne stvara dovoljno testosterona u organizmu (stanje poznato kao hipogonadizam).
Nakon provedene ocjene, zaključeno je da nema konzistentnih dokaza koji bi upućivali na to da ovi lijekovi povećavaju rizik od srčanih tegoba u muškaraca koji boluju od hipogonadizma. Ovaj zaključak donesen je na temelju ocjene dostupnih ispitivanja lijeka, pri čemu je uočeno da su rezultati ispitivanja inkonzistentni: neka ispitivanja su ukazivala na povećani kardijalni rizik, neka nisu, a neka su imala takva ograničenja u dizajnu ispitivanja da nije bilo moguće izvući zaključke iz tih ispitivanja. Također je ocijenjeno da i manjak testosterona nosi rizik od srčanih tegoba.
Zaključeno je da koristi primjene testosterona i dalje nadmašuju njegove rizike, ali je preporučeno da se lijekovi koji sadrže testosteron primjenjuju samo u odobrenim indikacijama, onda kada je manjak testosterona dokazan znakovima i simptomima, kao i laboratorijskim nalazima. Dodatno je ocijenjeno da u muškaraca koji boluju od teških srčanih, jetrenih ili bubrežnih bolesti liječenje testosteronom može uzrokovati teške komplikacije u obliku zadržavanja tekućine u tijelu, što je ponekad praćeno kongestivnim zatajenjem srca. U tim slučajevima liječenje se mora odmah prekinuti.
Zbog navedenog sigurnosnog pitanja javnost je informirana putem internetskih stranica HALMED-a te su izmijenjeni sažeci opisa svojstava lijeka i upute o lijeku odgovarajućih lijekova kako bi se uvrstile gore navedene informacije.
3.1.5. Lijekovi koji sadrže zolpidem
Tijekom 2014. godine na razini Europske unije provedena je ocjena lijekova koji sadrže zolpidem zbog zabrinutosti da se u nekih pacijenata mogu javiti omamljenost ili sporije reagiranje sljedeće jutro nakon uzimanja lijeka, što bi moglo povećati rizik od nesreća u aktivnostima koje zahtijevaju budnost, kao što je vožnja.
Zolpidem je lijek koji se koristi za kratkoročno liječenje nesanice u slučajevima kada nedostatak sna uzrokuje stres ili onemogućava funkcioniranje osobe.
Rizik od omamljenosti koja se javlja dan nakon uzimanja lijeka od ranije je poznat za lijekove koji se koriste u liječenju nesanice, osobito ako bolesnici nakon uzimanja lijeka ne spavaju dovoljno dugo, što je od ranije bilo navedeno u informacijama o lijeku za lijekove koji sadrže zolpidem.
Nakon provedene ocjene, zaključeno je da je u informacije o lijeku potrebno uvrstiti dodatna upozorenja vezana uz primjenu zolpidema. Naglašeno je da uobičajena preporučena dnevna doza, koju se ne smije prekoračiti, za odrasle ostaje 10 mg, a za starije bolesnike i bolesnike s oštećenom funkcijom jetre ostaje 5 mg. Bolesnici trebaju uzeti najnižu učinkovitu dozu zolpidema odjednom, neposredno prije odlaska na spavanje, a lijek ne smiju ponovno uzeti tijekom iste noći. Nadalje, bolesnici ne bi smjeli voziti ili izvoditi druge aktivnosti koje zahtijevaju mentalnu budnost barem 8 sati nakon što su uzeli zolpidem. S obzirom na to da je rizik od narušavanja sposobnosti vožnje veći ako se zolpidem uzima istodobno s drugim lijekovima koji imaju utjecaj na središnji živčani sustav (mozak i leđnu moždinu), kao i s alkoholom ili nedopuštenim tvarima, navedeno se ne bi smjelo uzimati istodobno sa zolpidemom.
Zbog navedenog sigurnosnog pitanja javnost je informirana putem internetskih stranica HALMED-a te su izmijenjeni sažeci opisa svojstava lijeka i upute o lijeku odgovarajućih lijekova kako bi se uvrstile gore navedene informacije.
3.1.6. Lijekovi namijenjeni za hitnu kontracepciju
Tijekom 2014. godine na razini Europske unije provedena je ocjena lijekova namijenjenih za hitnu kontracepciju, a koji sadrže djelatne tvari levonorgestrel ili ulipristalacetat. Ocjena ovih lijekova provedena je zbog zabrinutosti da su slabije učinkoviti u sprječavanju neplanirane trudnoće nakon nezaštićenog snošaja ili zatajenja kontracepcijske metode u žena s većom tjelesnom masom, što je uočeno u nekim kliničkim ispitivanjima.
Lijekovi za hitnu kontracepciju zaustavljaju i/ili odgađaju ovulaciju. Lijekovi za hitnu kontracepciju koji sadrže levonorgestrel mogu se koristiti do 72 sata nakon nezaštićenog snošaja ili zatajenja kontracepcijske metode, dok se lijekovi koji sadrže ulipristalacetat mogu koristiti do 120 sati nakon nezaštićenog snošaja ili zatajenja kontracepcijske metode.
Nakon provedene ocjene, zaključeno je da ovi lijekovi ostaju primjeren izbor u žena neovisno o tjelesnoj masi. Naime, uočeno je da u dijelu dostupnih kliničkih ispitivanja za navedene djelatne tvari postoji trend smanjenja učinkovitosti s porastom tjelesne mase, ali takav trend nije uočen u drugim kliničkim ispitivanjima. Stoga je ocjenjeno da su postojeći podaci nedostatni za izvođenje definitivnih zaključaka o smanjenju učinkovitosti hitnih kontraceptiva s porastom tjelesne mase.
Zaključeno je da se hitni kontraceptivi i dalje smiju primijeniti nakon nezaštićenog snošaja ili zatajenja korištene kontracepcijske metode. Međutim, kako bi se povećala vjerojatnost da će lijekovi djelovati, važno ih je uzeti što je ranije moguće nakon nezaštićenog snošaja.
HALMED podsjeća pacijentice da su hitni kontraceptivi iznimna rezervna metoda sprječavanja trudnoće, koja nikako ne smije biti zamjena za uobičajene redovne metode kontracepcije (kao što je uzimanje kombiniranih hormonskih kontraceptiva). Zdravstveni radnici također trebaju nastaviti podsjećati pacijentice o navedenom.
Zbog ovog sigurnosnog pitanja javnost je informirana putem internetskih stranica HALMED-a te su izmijenjeni sažeci opisa svojstava lijeka i upute o lijeku odgovarajućih lijekova kako bi se uvrstile gore navedene informacije.
Tijekom 2014. godine na razini Europske unije provedena je ocjena načina izdavanja hitnog kontraceptiva ellaOne, čija je djelatna tvar ulipristalacetat.
Lijek ellaOne je hitni kontraceptiv koji se koristi za sprječavanje neplanirane trudnoće ako se uzme unutar 120 sati (pet dana) nakon nezaštićenog snošaja ili zatajenja kontracepcijske metode. Djeluje na način da sprječava ili odgađa ovulaciju. ellaOne ima najbolji učinak ako se uzme u roku od 24 sata.
Lijek ellaOne odobren je u EU od 2009. godine, a o rizicima i koristima njegove primjene do danas je prikupljen i obrađen opsežan skup sigurnosnih informacija. Sigurnosni profil ovog lijeka usporediv je s profilom hitnih kontraceptiva koji sadrže levonorgestrel, koji su najčešće primjenjivani hitni kontraceptivi u EU. Hitni kontraceptivi koji sadrže levonorgestrel su u većini zemalja EU dostupni bez recepta i odobreni za primjenu unutar 72 sata nakon nezaštićenog snošaja ili zatajenja kontracepcijske metode.
Na temelju ocjene dostupnih informacija, u navedenom postupku ocijenjeno je da se lijek ellaOne može sigurno i učinkovito koristiti bez liječničkog recepta. Stoga je Europska agencija za lijekove (EMA) usvojila preporuku za promjenu u načinu izdavanja ovog lijeka iz izdavanja na recept u izdavanje bez recepta. Očekuje se da bi izdavanje bez recepta trebalo korisnicama ubrzati pristup ovom lijeku i stoga povećati njegovu učinkovitost. Slijedom preporuke EMA-e, Europska komisija (EK) usvojila je odluku o promjeni načina izdavanja ovog lijeka, koja je pravno obvezujuća za zemlje članice Europske unije, uključujući i Republiku Hrvatsku.
HALMED ovim putem podsjeća da je hitna kontracepcija lijekom ellaOne metoda koja se koristi samo kao iznimna rezervna metoda sprječavanja trudnoće, koja ne smije zamijeniti uobičajene redovne metode kontracepcije.
Zbog navedenog pitanja javnost je informirana putem internetskih stranica HALMED-a te je izmijenjen sažetak opisa svojstava lijeka i uputa o lijeku kako bi se uvrstile gore navedene informacije.
3.1.8. Lijekovi Procoralan i Corlentor
Tijekom 2014. godine na razini Europske unije provedena je ocjena sigurnosti primjene lijekova Corlentor i Procoralan, čija je djelatna tvar ivabradin. Ocjena je provedena zbog zabrinutosti da ovi lijekovi nose rizik od srčanog udara i bradikardije (prekomjerno usporen rad srca).
Navedeni lijekovi koriste se za simptomatsko liječenje u odraslih osoba s kroničnom stabilnom anginom (boli u prsnom košu koja je posljedica loše opskrbe srca krvlju) ili s kroničnim zatajenjem srca (kada srce ne može opskrbljivati ostatak tijela dovoljnom količinom krvi).
Ocjena ovih lijekova započela je temeljem analize sigurnosnog signala iz preliminarnih rezultata studije SIGNIFY, koja je pokazala malo, ali značajno povećanje kombiniranog rizika od kardiovaskularne smrti ili nefatalnog srčanog udara uz primjenu lijeka u određenih pacijenata sa simptomatskom anginom, a podaci su također ukazali na povećani rizik od bradikardije u odnosu na placebo.
Kako bi se umanjio rizik od navedenih srčanih nuspojava, usvojene su preporuke koje se odnose na puls u mirovanju u bolesnika prije uvođenja lijeka u terapiju ili kod prilagodbe doze, preporuke o tome kada je potrebno prekinuti liječenje i preporuke o istodobnoj primjeni drugih lijekova. Također su usvojene preporuke o praćenju pojave fibrilacije atrija (stanje u kojem su srčani otkucaji nepravilni i često abnormalno ubrzani), s obzirom na to da su bolesnici liječeni ivabradinom pod rizikom od pojave fibrilacije atrija. Nadalje, preporučeno je da se kod liječenja angine ivabradin koristi samo za ublažavanje simptoma jer dostupni podaci ne ukazuju na to da lijek nosi koristi u ishodima kao što su smanjenje rizika od srčanog udara ili smrti od kardiovaskularnih razloga (smrt zbog srčanih problema).
Zbog navedenog sigurnosnog pitanja u dva je navrata upućeno pismo zdravstvenim radnicima, javnost je informirana putem internetskih stranica HALMED-a te su izmijenjeni sažeci opisa svojstava lijeka i upute o lijeku odgovarajućih lijekova kako bi se uvrstila navedena ograničenja primjene i ostale nove informacije.
3.1.9. Transdermalni flasteri koji sadrže fentanil
Tijekom 2014. godine na razini Europske unije provedena je ocjena sigurnosti primjene lijekova koji sadrže fentanil, a koje se primjenjuje u obliku transdermalnih flastera. Ovo pitanje ocjenjivalo se zbog zabrinutosti oko rizika od potencijalno životno ugrožavajućih nuspojava kao posljedice slučajne izloženosti transdermalnim flasterima onih osoba kojima nije namijenjeno liječenje ovim lijekovima, osobito djece.
Fentanil je vrlo jaki opioidni analgetik (lijek protiv bolova), koji se može primjenjivati u obliku transdermalnih flastera (flastera koji se lijepe na kožu) kako bi se osiguralo kontinuirano otpuštanje lijeka dok je flaster zalijepljen na kožu. Ovi lijekovi primjenjuju se za liječenje dugotrajne i teške boli, kao što je bol kod karcinoma.
Slučajna izloženost transdermalnim flasterima koji sadrže fentanil nije novo sigurnosno pitanje. Međutim, kontinuirano se javljaju slučajne izloženosti koje su u nekim slučajevima dovele do smrtnog ishoda (svi su slučajevi uključivali djecu).
Kako bi se spriječile potencijalno životno ugrožavajuće nuspojave nakon slučajne izloženosti fentanilu, zdravstvene radnike se podsjetilo na važnost pružanja jasnih informacija bolesnicima i njegovateljima koje se odnose na rizik slučajnog prijenosa flastera, njegovog slučajnog gutanja i na potrebu za prikladno odlaganje flastera. Također je zaključeno da je smanjena vidljivost flastera mogla doprinijeti pojavi slučajne izloženosti. Stoga je zaključeno da je potrebno poboljšati vidljivost ovih flastera.
Zbog navedenog pitanja poduzeti su koraci za poboljšanje vidljivosti ovih flastera, upućeno je pismo zdravstvenim radnicima, a javnost je informirana putem internetskih stranica HALMED-a.
3.2. Pregled ostalih pitanja vezanih uz sigurnost primjene lijekova u 2014. godini
3.2.1. HALMED obilježio 40 godina spontanog prijavljivanja nuspojava u Hrvatskoj
HALMED je 2014. godine obilježio četrdeset godina spontanog prijavljivanja sumnji na nuspojave lijekova na području Republike Hrvatske. Povodom ove obljetnice značajne za praćenje sigurnosti primjene lijekova, HALMED je na svojim je internetskim stranicama priredio niz informativnih tekstova okupljenih u prigodnu rubriku "40 godina spontanog prijavljivanja nuspojava u Hrvatskoj" kako bi pacijente i korisnike lijekova pobliže upoznao s važnošću i načinima prijavljivanja sumnji na nuspojave lijekova, kao i sa sustavom praćenja sigurnosti primjene lijekova u RH.
S praksom prijavljivanja sumnji na nuspojave u Republici Hrvatskoj započelo se davne 1974. godine, nepunih deset godina nakon Velike Britanije, kolijevke spontanog prijavljivanja nuspojava u svijetu.
Duga hrvatska tradicija praćenja sigurnosti lijekova obilježena je brojnim uspjesima te se RH posljednjih godina redovito nalazi među prvih 20 država u svijetu po broju i kvaliteti prijava nuspojava na milijun stanovnika, sukladno podacima koje objavljuje Uppsala Monitoring Centre (UMC), suradni centar Svjetske zdravstvene organizacije (WHO) koji vodi svjetsku bazu nuspojava. Ovo je razultat zajedničkih napora HALMED-a i svih zdravstvenih radnika, pacijenata i nositelja odobrenja za stavljanje lijekova u promet koji redovito prijavljuju sumnje na nuspojave. Veći broj prijava indikator je kvalitete sustava prijavljivanja nuspojava te svaka dodatna prijava znači dodatnu informaciju o lijeku za korisnike lijeka i zdravstvene radnike, što u konačnici dovodi do sigurnije primjene lijekova.
Uz zdravstvene radnike i nositelje odobrenja za stavljanje lijeka u promet, odnosno proizvođače lijekova, koji su zakonski obvezni prijavljivati nuspojave, još od jeseni 2009. godine u Republici Hrvatskoj i pacijenti i korisnici lijekova mogu svaku sumnju na nuspojavu prijaviti izravno HALMED-u. U kolovozu 2012. godine HALMED je prvi u svijetu započeo s korištenjem on-line aplikacije Uppsala Monitoring Centra, suradnog centra WHO-a, koja pacijentima i korisnicima lijekova omogućuje aktivno i jednostavno sudjelovanje u praćenju sigurnosti primjene lijekova. Aplikacija je dostupna na internetskim stranicama HALMED-a u dijelu Za pacijente/On-line prijava sumnje na nuspojavu.
Prijavljivanje nuspojava je iznimno važno jer analizom prikupljenih podataka možemo bolje shvatiti sigurnosni profil lijeka što omogućuje propisivanje i uzimanje lijekova na najučinkovitiji i najsigurniji mogući način. Na taj način se hrvatskim pacijentima neprekidno osiguravaju kvalitetni i sigurni lijekovi te se izravno doprinosi zaštiti javnoga zdravlja, kao i zdravlja svakog pojedinog pacijenta koji lijek primjenjuje.
Stoga pozivamo sve pacijente i korisnike lijekova da posjete internetske stranice HALMED-a i navedenu novu rubriku, informiraju se o sigurnosti primjene lijekova te nam prijave svaku sumnju na nuspojavu lijeka.
3.2.2. HALMED ocijenjen jednom od najboljih agencija u EU regulatornoj mreži lijekova
U sklopu programa ocjenjivanja poslovanja agencija za lijekove unutar Europskog gospodarskog prostora (EGP), HALMED je dobio najveći broj ocjena izvrstan (5) među svim do sada ocijenjenim agencijama za lijekove, a mnogi indikatori poslovanja HALMED-a ocijenjeni su kao najbolja praksa na razini Europske unije. Navedenim iznimnim rezultatima HALMED se svrstao u sam vrh agencija u EU regulatornoj mreži lijekova. U skladu s visokim ocjenama pojedinih indikatora poslovanja, HALMED je ocijenjen i iznimno visokom ukupnom ocjenom - 4,14 od mogućih 5,0.
Program ocjenjivanja pod nazivom Benchmarking of European Medicines Agencies (BEMA) provodi tijelo Heads of Medicines Agencies (HMA). Za vrijeme boravka u HALMED-u od 21. do 24. listopada 2014. godine BEMA-ini ocjenitelji temeljito su pregledali poslovne procese i dokumente HALMED-a, kako bi mogli provesti konačnu evaluaciju poslovanja HALMED-a. Najviše ocjene HALMED je dobio u ocjeni aspekata poslovanja koji uključuju edukaciju interesnih skupina i promociju prijavljivanja na području sigurnosti, kakvoće i djelotvornosti lijekova, HALMED-ov sustav kakvoće, kontinuirano unapređenje poslovanja, upravljanje sukobom interesa, sustav praćenja rokova te provođenje nadzora farmakovigilancijskog sustava.
Cilj navedenog sustava je procijeniti trenutačni rejting agencije, identificirati najbolje prakse u pojedinim europskim agencijama te pružiti prijedloge za daljnja poboljšanja u poslovanju. BEMA je do sada imala tri ciklusa, a HALMED je u postupku ocjenjivanja sudjelovao prvi put.
3.2.3. Suradnjom HALMED-a i HZZO-a Pisma zdravstvenim radnicima postala dostupna u CEZIH-u
Tijekom 2014. HALMED je s Hrvatskim zavodom za zdravstveno osiguranje (HZZO) uspostavio suradnju na području unaprjeđenja sigurnosti primjene lijekova. Jedan od ciljeva suradnje je i unaprjeđenje dostupnosti važnih informacija o sigurnosti primjene lijekova zdravstvenim radnicima.
Takve informacije uobičajeno su sadržaj Pisama zdravstvenim radnicima (DHPC, od engl. Direct Healthcare Professional Communication ili DDL, od engl. Dear Doctor Letter). Pismo zdravstvenim radnicima je informacija kojom se osigurava sigurna i djelotvorna uporaba lijekova, a zdravstvenim radnicima dostavlja ga HALMED ili nositelj odobrenja. Pismo ne smije sadržavati nikakav oblik oglašavanja lijeka, a nositelj odobrenja obvezan s HALMED-om postići dogovor u vezi sa sadržajem, planom komunikacije, popisom primatelja i rasporedom dostave Pisma. Pismo zdravstvenim radnicima upućuje se u situacijama kada postoji potreba za hitnim djelovanjem ili je potrebno promijeniti trenutnu praksu vezanu uz određeni lijek. Navedene situacije uključuju primjerice oduzimanje odobrenja za stavljanje u promet zbog sigurnosnih razloga, ograničavanje indikacije, uvođenje kontraindikacije ili promjenu preporučene doze lijeka, sve također iz sigurnosnih razloga, kao i ograničenje dostupnosti lijeka s mogućim štetnim posljedicama na skrb za bolesnike te druge situacije kada se slanjem Pisma nastoji osigurati sigurna i učinkovita primjena lijeka.
HALMED Pisma objavljuje na svojim internetskim stranicama, a kroz suradnju s HZZO-om Pisma su tijekom 2014. godine postala dostupna zdravstvenim radnicima i putem Centralnog zdravstvenog informacijskog sustava Republike Hrvatske (CEZIH). Pisma su vidljiva prilikom propisivanja i izdavanja lijeka na kojeg se Pismo odnosi.
Dostupnost Pisama kroz CEZIH je dodatna mjera informiranja zdravstvenih radnika i ne može zamijeniti redovan sustav upućivanja Pisama zdravstvenim radnicima od strane nositelja odobrenja ili HALMED-a. Dostupnost Pisama kroz CEZIH omogućena je s ciljem osiguranja dodatnog podsjetnika za zdravstvene radnike na važna sigurnosna pitanja povezana s primjenom određenog lijeka. Svrha omogućavanja dostupnosti Pisama kroz CEZIH je unaprjeđenje sigurnosti primjene lijekova kroz što ranije prihvaćanje i početak primjenjivanja navedenih sigurnosnih informacija u svakodnevnom radu s pacijentima u smislu sigurnije i racionalnije farmakoterapije.
3.2.4. HALMED aktivno uključen u europske projekte vezane uz sigurnost primjene lijekova
HALMED je tijekom 2014. godine nastavio aktivno sudjelovati u europskim projektima vezanim uz sigurnost primjene lijekova pod nazivima SCOPE i WEB-RADR.
HALMED je izabran za voditelja radnog paketa koji se odnosi na spontano prijavljivanje nuspojava u okviru projekta Europske komisije pod nazivom Joint Action on Strengthening Collaboration for Operating Pharmacovigilance in Europe (SCOPE). Glavni ciljevi HALMED-ovog radnog paketa uključuju identificiranje najboljih praksi vezanih uz sustave spontanog prijavljivanja nuspojava, razvijanje nacionalnih planova za spontano prijavljivanje nuspojava lijekova te razvijanje alata i metodologija za podizanje razine svijesti i motivacije zdravstvenih radnika i pacijenata za prijavu nuspojava nadležnim tijelima. Kao voditelj navedenog radnog paketa HALMED predvodi unapređenje sustava spontanog prijavljivanja nuspojava na razini Europske unije.
Cilj cjelokupnog projekta SCOPE je poboljšanje zdravstvene sigurnosti građana zemalja članica Europske unije kroz unapređenje učinkovitosti farmakovigilancijskih sustava u EU. Projekt je započeo 1. studenog 2013. godine, a planirano trajanje je tri godine. Sastoji se od osam tzv. radnih paketa za koje je kao voditelj određena po jedna zemlja članica EU. Ostale zemlje voditelji radnih paketa su Velika Britanija, Španjolska, Portugal, Nizozemska, Mađarska i Italija.
Odabir HALMED-a, kao predstavnika najmlađe zemlje članice, za voditelja jednog od paketa pokazuje da je hrvatsko iskustvo na području farmakovigilancije vrlo dobro prepoznato. U EU se cijeni HALMED-ovo iskustvo u praćenju nuspojava cjepiva kroz uspješnu i kontinuiranu suradnju s Hrvatskim zavodom za javno zdravstvo, kao i općenito vrlo proaktivni pristup farmakovigilanciji. Taj pristup očituje se u činjenici da je HALMED još 2012. godine prvi u svijetu počeo koristiti on-line aplikaciju UMC-a, suradnog centra WHO-a, za prijavu nuspojava od strane pacijenata. Dodatno, Hrvatska je prema broju i kvaliteti prijava sumnji na nuspojave na milijun stanovnika posljednjih godina redovito među prvih 20 zemalja od ukupno 117 zemalja svijeta koje sudjeluju u Međunarodnom programu praćenja sigurnosti lijekova Svjetske zdravstvene organizacije (WHO).
Krajem 2014. godine HALMED se aktivno uključio u projekt Europske komisije pod nazivom Innovative Medicines Initiative WEB-RADR (Recognising Adverse Drug Reactions). Riječ je o zajedničkom projektu privatnog i društvenog partnerstva (IMI projekti) kojem je cilj razviti što lakši i pristupačniji način prijavljivanja sumnji na nuspojave lijekova novim kanalima i društvenim mrežama. U navedenom projektu uz HALMED aktivno sudjeluju, između ostalih, Europska agencija za lijekove (EMA), Uppsala Monitoring Centre (UMC), suradni centar WHO-a koji vodi svjetsku bazu nuspojava, Britanska agencija za lijekove (MHRA) i Nizozemski nacionalni centar za praćenje nuspojava (LAREB). HALMED je za svoj rad dobio pohvalu od Američke agencije za hranu i lijekove (FDA) te će Hrvatska, zajedno s FDA-om, dati volonterski doprinos projektu kako bi se omogućilo prijavljivanje sumnji na nuspojave putem mobilnih aplikacija.
Projekt WEB-RADR namijenjen je razvoju novih alata za prikupljanje informacija o sumnjama na nuspojave lijekova, kao i istraživanju primjene novih tehnologija i platformi u praćenju sigurnosti primjene lijekova na području Europske unije. Projektom je predviđen razvoj mobilne aplikacije za prijavljivanje sumnji na nuspojave lijekova regulatornim tijelima za lijekove u EU-a, kao i razvoj alata za pretraživanje relevantnih podataka na društvenim mrežama. U sklopu projekta bit će provedeno i opsežno znanstveno istraživanje na temelju kojeg će biti donesene preporuke o budućoj uporabi ovih alata u farmakovigilanciji u svrhu zaštite javnog zdravlja.
3.2.5. HALMED sudjelovao u obilježavanju Međunarodnog dana rijetkih bolesti
HALMED se 2014. godine pridružio Hrvatskom savezu za rijetke bolesti u obilježavanju Međunarodnog dana rijetkih bolesti. Predstavnici HALMED-a su u sklopu ovog obilježavanja za pacijente i studente medicine i farmacije održali radionice o važnosti prijavljivanja nuspojava u Osijeku, Rijeci, Puli, Splitu, Dubrovniku, Bjelovaru, Križevcima i Zagrebu, a dodatno je u Zagrebu u sklopu 3. Hrvatskog simpozija i nacionalne konferencije o rijetkim bolestima s međunarodnim sudjelovanjem održano izlaganje o ulozi HALMED-a u dostupnosti lijekova za teške i rijetke bolesti (tzv. orphan lijekovi) nakon ulaska u Europsku uniju.
Rijetke bolesti definirane su kao po život opasna stanja ili bolesti koje vode do kronične slabosti, a od kojih boluje najviše pet od 10,000 osoba u EU. Procjenjuje se da u zemljama Europske unije (EU) oko 30 milijuna ljudi pati od rijetke bolesti. Međunarodni dan rijetkih bolesti obilježava se svake godine posljednjeg dana u veljači. Cilj obilježavanja Međunarodnog dana rijetkih bolesti jest podizanje svijesti šire javnosti o rijetkim bolestima te olakšavanje dostupnosti terapijskih mogućnosti pacijentima.
Hrvatski savez za rijetke bolesti (HSRB) okuplja udruge s članovima oboljelim od rijetkih bolesti, pojedince oboljele od rijetkih bolesti te osobe s invaliditetom koji je posljedica rijetke bolesti, a u svrhu ostvarivanja, usklađivanja i zaštite njihovih pojedinačnih i zajedničkih prava i interesa.
3.2.6. HALMED domaćin značajnih međunarodnih farmakovigilancijskih skupova
Intenzivnim zalaganjem HALMED je tijekom 2014. godine osigurao domaćinstvo čak triju uvaženih međunarodnih farmakovigilancijskih skupova.
Prvi skup pod nazivom "Proaktivna farmakovigilancija i upravljanje rizicima u razdoblju individualizirane terapije" održan je 3. i 4. travnja 2014. godine u Zagrebu, a suorganizator skupa bilo je Međunarodno društvo za farmakovigilanciju (International Society of Pharmacovigilance, ISoP). Skup je ocjenjen iznimno uspješnim, a prisustvovali su mu predstavnici regulatornih tijela, farmaceutske industrije i akademske zajednice.
U Dubrovniku je 22. i 23. svibnja 2014. godine održan neformalni sastanak Povjerenstva za ocjenu rizika na području farmakovigilancije (PRAC) Europske agencije za lijekove (EMA). Sudionike su na početku sastanka pozdravile dr. sc. Viola Macolić Šarinić, dr. med., spec., ravnateljica HALMED-a, i dr. June Raine, predsjednica PRAC-a i voditeljica Odjela za vigilanciju i upravljanje rizicima lijekova pri Britanskoj agenciji za lijekove (Medicines and Healthcare Products Regulatory Agency, MHRA). Dr. Raine je u pozdravnom govoru zahvalila hrvatskim članovima PRAC-a na značajnom doprinosu radu Povjerenstva, naglasivši da je riječ o iznimnom uspjehu nove zemlje članice EU-a.
Predavanja i rasprave obuhvaćali su aktualne teme iz područja sigurnosti primjene lijekova, kao što su učinkovitost mjera minimizacije rizika, planovi minimizacije rizika za generičke lijekove, detekcija sigurnosnih signala, arbitražni postupci, značaj farmakoepidemiologije i farmakogenomike za farmakovigilanciju, dostupnost centralizirano odobrenih lijekova u manjim zemljama članicama EU te suradnja PRAC-a s Povjerenstvom za humane lijekove (CHMP) EMA-e. Sastanku je prisustvovalo 50-ak pozvanih stručnjaka iz nadležnih tijela za lijekove iz 22 zemlje članice Europske unije, a među predavačima su bila i tri djelatnika HALMED-a.
PRAC je povjerenstvo EMA-e osnovano temeljem zakonodavstva na području farmakovigilancije koje je u Europskoj uniji stupilo na snagu u srpnju 2012. godine s ciljem unapređenja zaštite i promicanja javnog zdravlja kroz jačanje farmakovigilancijskog sustava EU-a. Članovi PRAC-a su stručnjaci iz regulatornih tijela zemalja članica Europske unije (nacionalnih agencija za lijekove) te predstavnici pacijenata i zdravstvenih radnika delegirani od Europske komisije. U radu PRAC-a kao aktivni članovi sudjeluju i delegati iz HALMED-a kao hrvatski predstavnici.
Uloga PRAC-a je dodatno osnažiti postojeći sustav nadziranja sigurnosti lijekova za primjenu u ljudi u cijeloj EU. Povjerenstvo je zaduženo za otkrivanje, procjenu, minimizaciju i komunikaciju vezanu uz rizike nastanka nuspojava lijekova, pri čemu se u obzir uzima terapijski učinak lijeka. Odgovorno je za osmišljavanje i vrednovanje postmarketinških ispitivanja sigurnosti primjene lijeka, kao i za inspekciju farmakovigilancije. Glavna je odgovornost PRAC-a pripremanje preporuka vezanih uz pitanja iz područja farmakovigilancije te uz sustave upravljanja rizikom, čiju učinkovitost nadzire. Povjerenstvo ima ovlasti dati znanstvenu procjenu u slučajevima kada zemlja članica EU ili Europska komisija zatraže pokretanje arbitražnog postupka u EU-u za ocjenu sigurnosti ili odnosa koristi i rizika za pojedini lijek ili skupinu lijekova.
Kao treći značajan farmakovigilancijski skup, u Zagrebu je od 17. do 19. rujna 2014. godine održana EudraVigilance radionica o prijavljivanju Sigurnosnih izvješća o pojedinačnom slučaju (ICSR) u elektroničkom obliku na području Europskog gospodarskog prostora, u organizaciji udruge Drug Information Association (DIA) i Europske agencije za lijekove (EMA). Polaznici radionice bili su korisnici sustava EudraVigilance, a na kraju radionice održana je provjera stečenih znanja. Uspješnim sudionicima dodijeljene su potvrde o završenom tečaju te im je omogućeno prijavljivanje ICSR-e EMA-i i/ili nadležnim nacionalnim tijelima putem sustava EudraVigilance.
Ova radionica jedini je program osposobljavanja koji priznaje Europska agencija za lijekove. HALMED je sustav EudraVigilance implementirao u ožujku 2010. godine.
EudraVigilance je baza za prikupljanje prijava sumnji na nuspojave za zemlje Europskog gospodarskog prostora (EGP). Te se prijave koriste za procjenu koristi i rizika lijekova tijekom njihovog razvoja i za potrebe praćenja njihove sigurnosti nakon dobivanja odobrenja za stavljanje u promet. EudraVigilance je u uporabi od prosinca 2001. godine, a razvija ga i održava Europska agencija za lijekove.





