Lijekovi
Odnos između Europske i Hrvatske farmakopeje
Zašto je potrebno, uz Ph. Eur., objavljivati HRF?
Nekoliko je razloga zbog kojih je Hrvatska odlučila objavljivati Hrvatsku farmakopeju:
- Prvi i najvažniji jest olakšati implementaciju zahtjeva Europske farmakopeje prevođenjem najvažnijih tekstova na hrvatski jezik;
- Drugi je razvijati i održavati hrvatsko stručno nazivlje iz područja farmacije;
- Treći je održati tradiciju izrade farmakopeje na nacionalnom jeziku, koja seže u davnu 1888. godinu kad je objavljen prvi prijevod na hrvatski jezik drugog izdanja Mađarske farmakopeje, koja je tada bila na snazi u Hrvatskoj. Nakon njega su 1901. godine profesori Gustav Janeček i Julije Domac objavili, među tada vrlo rijetkim nacionalnim farmakopejama, originalnu Hrvatsko-slavonsku farmakopeju, s velikim poštovanjem primljenu u svijetu. Sve daljnje farmakopeje korištene u Hrvatskoj do osamostaljenja nose u sebi tragove te farmakopeje ili su velikim dijelom izrađene u Hrvatskoj, koja je sve to vrijeme njegovala znanja i sposobnosti izrade farmakopejskih tekstova.
Po čemu se HRF razlikuje od Ph. Eur.?
Kao zemlja potpisnica Konvencije o izradi Europske farmakopeje (od rujna 1994. godine), Hrvatska prihvaća Europsku farmakopeju kao obvezujuću. Nije propisan način kako se propisi Europske farmakopeje implementiraju u zemljama potpisnicama. Hrvatska je odabrala objavljivanje Hrvatske farmakopeje u kojoj su prihvaćeni svi tekstovi Ph. Eur. i prevedeni njihovi nazivi, a radi lakšeg pretraživanja prihvaćena je struktura Ph. Eur. Iz Europske su farmakopeje, radi lakše implementacije prevedeni, za Hrvatsku najvažniji tekstovi i velik broj harmoniziranih monografija koje obuhvaćaju najčešće korištene pomoćne tvari.
Popis najčešće korištenih tekstova dobiven je velikom anketom svih korisnika u Hrvatskoj. Uz prevedene monografije, prevedeni su i opći članci i reagensi potrebni za izvođenje ispitivanja prema određenoj monografiji, čime je zapravo preveden velik dio općih članaka i općih monografija. Odabrani tekstovi Ph. Eur. u HRF-u su prevedeni u cijelosti ili djelomice.
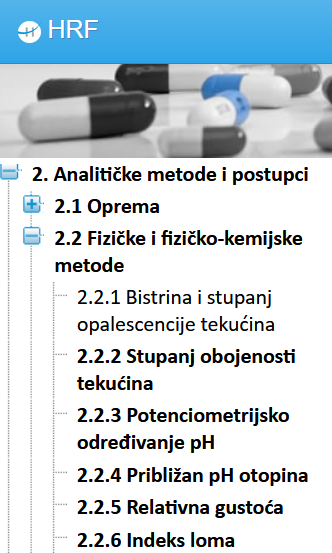
Kad je tekst Europske farmakopeje preveden u cijelosti, u "stablu" sadržaja na lijevoj strani HRF-a i u tablicama s popisima tekstova u pojedinačnim poglavljima nazivi tih tekstova navedeni su podebljanim slovima (slika 1).
Kad tekst nije preveden u cijelosti, tad na navedenim mjestima njegov naslov nije naveden podebljanim slovima.
U monografijama djelatnih i pomoćnih tvari prije ulomka koji nije preveden u cijelosti nalazi se, kosim slovima ispisan, sljedeći tekst: "Ovaj ulomak donosi samo zahtjeve kakvoće, bez detaljnog opisa svih postupaka."
Sve monografije biljnih droga prevedene su najmanje u dijelu OPIS i u tablici imaju poveznice na prevedeni tekst iz tablice, a monografije biljnih droga koje su prevedene u cijelosti, podebljane su u tablici i u "stablu" sadržaja (lijevo u HRF-u), a poveznice vode do teksta monografije (slika 2).
Dosad smo preveli sve tražene tekstove. Prijevodi su doslovni i u potpunosti usklađeni s Ph. Eur. Zahtjevi za prijevode tekstova monografija se trajno zaprimaju preko predstavnika korisnika u Povjerenstvu za farmakopeju ili na adresu UredZaFarmakopeju@halmed.hr. U svakom izdanju/dodatku HRF-a objavljujemo nove prijevode Ph. Eur. i tako obogaćujemo njegov sadržaj.
Osim obvezujućih tekstova, u HRF-u povremeno objavljujemo i tzv. neobvezujuće tekstove, koji bi, prema procjeni Povjerenstva za farmakopeju, mogli biti korisni našim korisnicima. Ti tekstovi objavljuju se zasebno, od poglavlja 15 dalje.
Usporedni popis Tekstova Europske farmakopeje i prevedenih tekstova možete naći u tablici.
Preko sljedeće poveznice možete pregledati demo-verziju Hrvatske farmakopeje.
Kako mogu znati koje izdanje HRF-a odgovara određenom izdanju Ph. Eur.?
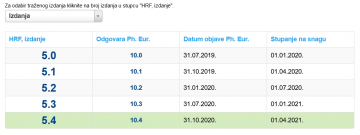
Izdanje Hrvatske farmakopeje iz 2007. godine računamo kao prvo izdanje Hrvatske farmakopeje u samostalnoj državi. Njezinu reviziju u online obliku objavili smo 2013. godine kao drugo izdanje (usklađeno s izdanjem 7.8 Ph. Eur.), a sljedeće nakon toga, usklađeno s 8.0 izdanjem Ph. Eur., objavljeno je kao HRF 3.0.
Otad su izdanja HRF-a numerirana brojkom koja je za 5 manja od izdanja Ph. Eur. (npr. HRF 4.8 odgovara izdanju 9.8 Ph. Eur.) i svako je usklađeno s odgovarajućim izdanjem/dodatkom Ph. Eur.
Zašto HRF ne sadrži prijevode svih tekstova Ph. Eur.?
Velika anketa svih korisnika farmakopeje u Hrvatskoj, provedena prije objavljivanja drugog izdanja HRF-a, pokazala je da se svi tekstovi Ph. Eur. u praksi kod nas niti ne koriste, pa bi prijevod i trajno ažuriranje svih tekstova predstavljali nepotrebno trošenje ionako skromnih resursa. U skladu sa smanjenim sadržajem, i cijena licence za HRF je znatno niža od cijene licence za Ph. Eur.
Međutim, sve tekstove s popisa korištenih tekstova smo za korisnike preveli i taj popis prijevoda stalno proširujemo. Zahtjevi za prijevode tekstova se trajno primaju preko predstavnika korisnika u Povjerenstvu za farmakopeju ili na adresu UredZaFarmakopeju@halmed.hr. U svakom izdanju/dodatku HRF-a objavljujemo nove prijevode Ph. Eur. i tako obogaćujemo njegov sadržaj.
Zašto zahtjevi Ph. Eur. stupaju na snagu tek nakon šest mjeseci? Postoje li u tome iznimke i kako onda mogu znati za njih?
Kod objava novih i revizija postojećih zahtjeva često se uvode novi reagensi, standardi, metode ili tehnike, za što je korisniku potrebno određeno vrijeme za nabavu, edukaciju, prilagodbu, verifikaciju ili validaciju metode i sl., stoga se korisnicima ostavlja šest mjeseci za prilagodbu prije nego što propis postane obvezujući.
Hrvatska farmakopeja u tom razdoblju radi usklađivanje s izmjenama Ph. Eur., ali odgovarajuće izdanje/dodatak objavljujemo, u pravilu, najmanje dva mjeseca prije stupanja na snagu.
Postoje iznimke kad se zbog određene žurnosti izmjene objavljuju u roku od mjesec dana od objave izdanja/dodatka u kojem je izmjena objavljena. Na to se korisnicima skreće pozornost na više mjesta u samom izdanju, na ulaznoj stranici online izdanja i na stranicama EDQM-a.
Najžurnije izmjene objavljuju se neovisno o izdanju/dodatku i odmah implementiraju, a obavijesti o tome također se objavljuju na više mjesta, na ulaznoj stranici online izdanja i na stranicama EDQM-a.
Sve žurne izmjene donose se posebnim rezolucijama Vijeća Europe.
Obavijesti o žurnim izmjenama HALMED objavljuje na svojim mrežnim stranicama, u Novostima.
Kako mogu znati koje je izdanje HRF-a važeće?
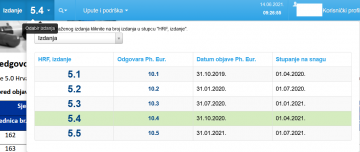
U pravilu, kod otvaranja aplikacije Hrvatska farmakopeja uvijek vam se otvara važeće izdanje, čiji broj možete vidjeti u zaglavlju.
U ostala izdanja možete ući izbornikom u zaglavlju i birati između Izdanja i Arhiviranih izdanja u kojima se nalaze nešto starija izdanja koja se, u pravilu, manje koriste.
Napominjemo da u zaglavlju možete imati i izdanje koje je objavljeno, ali još nije stupilo na snagu, pa ga morate sami, prema izboru, otvoriti.
U izborniku u zaglavlju također možete vidjeti kad su pojedina izdanja objavljena, a kad stupila na snagu.
U navedenom izborniku možete vidjeti koje izdanje HRF-a odgovara kojem izdanju Ph. Eur.
Zašto se uvriježeni tehnički pojmovi prevode na hrvatski jezik?
Jedan od glavnih ciljeva Hrvatske farmakopeje jest očuvanje i razvijanje stručnih farmaceutskih izraza na hrvatskom jeziku.
U Farmakopejskom rječniku je vidljivo da smo nastojali korisnicima ponuditi hrvatske prijevode stručnih naziva. Pritom smo kao izvore koristili brojne stručne rječnike, navedene u literaturi rječnika. Svjesni toga da se neki od izraza nisu ukorijenili u svakodnevnoj uporabi, a ponekad smo koristili i pohrvaćene međunarodne izraze kako ne bi došlo do pogrešnog tumačenja teksta. Tada smo u Farmakopejskom rječniku naveli oba ili više izraza, s time da smo prvome navedenom dali prednost. Napominjemo da za obveznike primjene Europske farmakopeje vrijedi da u slučaju nerazumijevanja teksta ili bilo kakvih sporova trebaju konzultirati tiskano izdanje na jednom od službenih jezika (engleski i francuski jezik).
Mogu li za izradu lijeka koristiti tvar čije monografije nema u Ph. Eur.?
Važeći Zakon o lijekovima (NN 76/13, 90/14, 100/18) u čl. 179. stavak 3. kaže: "Kakvoća lijeka i sirovina za proizvodnju lijeka, uključujući materijale za unutarnje pakiranje lijeka, mora biti u skladu s Hrvatskom farmakopejom, odnosno lijek mora biti proizveden i provjerene kakvoće u skladu s postupcima i zahtjevima važeće Europske farmakopeje. Ako lijek nije obuhvaćen Hrvatskom farmakopejom ni Europskom farmakopejom, njegova kakvoća mora odgovarati farmakopeji priznatoj u Europskoj uniji ili drugim međunarodnim priznatim normama."
Kad se navodi da je tvar/lijek u skladu s (odgovara) Ph. Eur., to znači da je primjenom odgovarajućih monografija Europske farmakopeje, ako je potrebno uz dodatak priložen ovjernici o prikladnosti monografije Europske farmakopeje (eng. certificate of suitability (CEP)), moguće provjeriti je li kakvoća tvari prikladna za uporabu u lijekovima ili nije. Drugim riječima, osigurava da se sva moguća zagađenja i onečišćenja iz ovog određenog načina proizvodnje (uključujući izvorne materijale) mogu u potpunosti kontrolirati zahtjevima monografija.
Ovjernicu o prikladnosti monografije Europske farmakopeje izdaje Europsko ravnateljstvo za kakvoću lijekova i zdravstvenu skrb (European Directorate for the Quality of Medicines & HealthCare - EDQM) nakon iscrpne ocjene dokumentacije o proizvodnji i mjesta proizvodnje određene tvari/lijeka.
Ako tvar/lijek nema potvrdu da odgovara Ph. Eur. ili nekoj drugoj farmakopeji priznatoj u Europskoj uniji ili drugim međunarodnim priznatim normama, znači da se ne može sa sigurnošću donijeti zaključak o njezinoj/njegovoj kakvoći. Kad proizvođač za izradu lijeka koristi tvari koje ne ispunjavaju ove uvjete, morat će dokazati, na način koji će prihvatiti i odobriti nadležno tijelo, da lijek odgovara Ph. Eur., nekoj drugoj farmakopeji priznatoj u Europskoj uniji ili drugim međunarodnim priznatim normama ili zahtjevima koje je postavio proizvođač.
Što znači da tvar odgovara Ph. Eur.?
Korištenje naslova ili podnaslova monografije Ph. Eur. podrazumijeva da tvar/proizvod udovoljava zahtjevima navedenima u odgovarajućoj monografiji. Kad se u tekstu Farmakopeje upućuje na monografiju, tada se navode naslov i odnosni broj monografije pisani udesno kosim (kurzivnim) slovima.
Pripravak mora udovoljavati zahtjevima tijekom propisanog roka valjanosti. Nadležno tijelo može odrediti drugačiji rok valjanosti i/ili zahtjeve kakvoće za otvarane ili odčepljene spremnike. Predmet bilo koje druge monografije mora udovoljavati zahtjevima tijekom cijelog razdoblja njegove uporabe. O naznačenom roku valjanosti za svaki proizvod, kao i o početnom vremenu otkad se računa, odlučuje nadležno tijelo na temelju eksperimentalnih rezultata dobivenih izučavanjem studija stabilnosti.
Ako u poglavlju Opće napomene ili u monografijama nije drugačije navedeno, navodi u monografijama su obvezujući zahtjevi. Opća poglavlja postaju obvezujuća kad se na njih poziva određena monografija, osim ako citati u tekstu pokazuju da navodi namjerno nisu postavljeni da bi obvezivali, tj. kad se navode samo kao obavijest.
Djelatne tvari, pomoćne tvari (ekscipijensi), farmaceutski pripravci i drugi proizvodi opisani monografijama namijenjeni su za humanu i veterinarsku primjenu (osim ako primjena nije izričito ograničena na samo jednu od tih skupina).
Norme kakvoće predstavljene monografijama valjane su samo kad su ti proizvodi izrađeni u sklopu odgovarajućeg sustava kakvoće. Sustav kakvoće mora osigurati da proizvodi dosljedno udovoljavaju farmakopejskim zahtjevima.
Dokaz usklađenosti s Farmakopejom
(1) Proizvod nije farmakopejske kakvoće ako ne udovoljava svim zahtjevima monografije. To ne znači da je proizvođač, kao preduvjet za puštanje proizvoda u promet, obvezan provesti sva ispitivanja navedena u monografiji da bi potvrdio da je proizvod usklađen sa zahtjevima Farmakopeje. Proizvođač može osigurati proizvod farmakopejske kakvoće na temelju njegova dizajna zajedno sa strategijom kontrole i izvedenim podacima, npr. iz validacijskih studija proizvodnog postupka.
(2) Za poboljšani pristup provjeri kakvoće kao alternative ispitivanju na kraju proizvodnje mogle bi se iskoristiti strategije procesne analitičke tehnologije (PAT) i/ili ispitivanja za puštanje u promet u realnom vremenu (uključujući parametarsko puštanje), i u okolnostima kad je nadležno tijelo procijenilo ispitivanje za puštanje u promet u realnom vremenu odgovarajućim, što ne isključuje potrebu udovoljavanja Farmakopeji.
(3) Smanjenje broja ispitivanja na životinjama - u skladu s 3R načelom, Europska farmakopeja posvećena je postupnom smanjivanju korištenja životinja u svrhu ispitivanja (eng. Replacement, Reduction, Refinement; zamjena pokusnog modela, smanjenje broja životinja u pokusima, usavršavanje metoda i postupaka na životinjama), postavljenim u Europskoj konvenciji za zaštitu kralježnjaka koji se koriste u ispitivanjima i u druge znanstvene svrhe. Kada dokazuju usklađenost s Farmakopejom, kako je navedeno gore pod (1), proizvođači mogu razmotriti uspostavu dodatnih sustava nadzora dosljednosti proizvodnje. Kad je u Farmakopeji propisano ispitivanje na životinjama, odabir ispitivanja u svrhu procjene usklađenosti s Farmakopejom, uz odobrenje nadležnog tijela, provodi se tako da se uporaba životinja svede na najmanju moguću mjeru.
Stupanj kakvoće tvari
Neki materijali opisani farmakopejskim monografijama mogu postojati u različitim stupnjevima kakvoće prikladnim za različite namjene. Ako u monografiji nije drugačije navedeno, zahtjevi se primjenjuju na sve stupnjeve kakvoće tvari. Uz neke monografije, posebice za pomoćne tvari, kao obavijest može biti dodan i popis odgovarajućih svojstava povezanih s posebnom namjenom (eng. functionality-related characteristics), važnih za uporabu takve tvari. Metode za određivanje jednog ili više tih svojstava mogu se dodati za informaciju.
Opće monografije
Tvari i pripravci koji su predmet pojedinačnih monografija moraju također udovoljavati i odgovarajućim, primjenjivim općim monografijama. Pojedinačne monografije uglavnom ne upućuju na primjenjive opće monografije.
Opće monografije primjenjuju se na sve tvari i pripravke obuhvaćene ulomkom Opis u općoj monografiji, osim kad preambula ograničava primjenu, primjerice na tvari i pripravke koji su predmeti farmakopejskih monografija.
Opće monografije farmaceutskih oblika primjenjuju se na sve pripravke opisane vrste. Ti zahtjevi nisu nužno sveobuhvatni za dani određeni pripravak i nadležno tijelo može postaviti dodatne zahtjeve uz one propisane općom monografijom.
Opće monografije i pojedinačne monografije međusobno se upotpunjuju. Ako se odredbe opće monografije ne primjenjuju na određeni proizvod, to se izričito navodi u pojedinačnoj monografiji.
Ovjernica o prikladnosti monografije Europske farmakopeje (eng. certificate of suitability (CEP))
Ovjernica o prikladnosti potvrđuje da je primjenom odgovarajućih monografija Europske farmakopeje, ako je potrebno uz dodatak priložen ovjernici, moguće provjeriti je li kakvoća tvari prikladna za uporabu u lijekovima ili nije. Drugim riječima, osigurava da se sva moguća zagađenja i onečišćenja iz ovog određenog načina proizvodnje (uključujući izvorne materijale) mogu u potpunosti kontrolirati zahtjevima monografija.
Kao obveznici primjene Europske farmakopeje, imamo li kakav utjecaj na njezin nastanak?
Postoji više načina kako sudjelujemo u nastanku/revizijama Europske farmakopeje:
- Hrvatska ima svoju tročlanu delegaciju koja redovito i aktivno sudjeluje u radu Europske farmakopeje. Više o aktivnostima Komisije Europske farmakopeje možete naći na ovoj stranici.
- Naši stručnjaci također izravno sudjeluju u radu stručnih i radnih grupa pri Europskoj farmakopeji. Njihovu se radu, pod propisanim uvjetima, možete i vi priključiti. O radu u stručnim i radnim grupama možete pročitati na stranici HALMED-a ili EDQM-a. Popis svih stručnih i radnih grupa EDQM-a možete naći na stranici. U cilju uspostavljanja uske suradnje između nacionalnog farmakopejskog tijela RH (NPA) s korisnicima farmakopeje u Hrvatskoj, drugim NPA-ima te Komisijom Europske farmakopeje (Komisija Ph. Eur.), njezinim stručnim grupama i radnim tijelima, u HALMED-u je osnovano Povjerenstvo za farmakopeju Agencije za lijekove i medicinske proizvode (Povjerenstvo HRF-a), koje je 15. listopada 2014. godine održalo svoju prvu sjednicu. Stalni sastav Povjerenstva, uz imenovane predstavnike Ureda za farmakopeju pri HALMED-u, čine predstavnici najraširenijih područja djelovanja farmacije u Republici Hrvatskoj, preko kojih možete uputiti svoja pitanja, komentare i prijedloge nacionalnom farmakopejskom tijelu ili Komisiji Europske farmakopeje. Više o radu Povjerenstva za farmakopeju možete pročitati na stranici. Na stranici možete naći raspored sjednica Povjerenstva i zapisnike s dosadašnjih sastanaka. Povjerenstvo možete kontaktirati na adresu UredZaFarmakopeju@halmed.hr.
- Europsko ravnateljstvo za kakvoću lijekova i zdravstvenu skrb (European Directorate for the Quality of Medicines & HealthCare - EDQM) objavljuje online časopis Pharmeuropa u kojem možete naći prijedloge novih i revizija tekstova Europske farmakopeje za javnu raspravu. Tekstovi su dostupni tri mjeseca i mogu se davati komentari, prijedlozi za ispravke i sl. Tek nakon što se svi dobiveni komentari objave, tekst će biti ponovno tiskan za raspravu preko Pharmeurope ili predan komisiji Europske farmakopeje na prihvaćanje. Preporučuje se da svoje komentare tekstova poduprete argumentima i šaljete ih EDQM-u preko nacionalnog farmakopejskog tijela, koje dalje o njemu vodi brigu do prihvaćanja ili odbijanja i o tome vas obavještava. Adresa nacionalnog farmakopejskog tijela je UredZaFarmakopeju@halmed.hr. Svoje zahtjeve za izradu novog teksta u Europskoj farmakopeji ili reviziju postojećeg možete poslati nacionalnom farmakopejskom tijelu. Upute o postupku možete naći na ovoj stranici. Adresa nacionalnog farmakopejskog tijela je UredZaFarmakopeju@halmed.hr.
Mogu li sudjelovati u radu HRF-a/Ph. Eur.?
Postoji više načina na koje možete sudjelovati u radu i nastajanju Europske farmakopeje:
- Djelatnici Ureda za farmakopeju ujedno su hrvatski delegati u Komisiji Europske farmakopeje. Možete im se izravno obratiti na adresu UredZaFarmakopeju@halmed.hr. Više o aktivnostima Komisije Europske farmakopeje možete naći na stranici.
- Komisija Ph. Eur. formira stalne stručne grupe i povremena radna tijela koja na dobrovoljnom načelu rješavaju zadatke izrade i revizije tekstova Ph. Eur. Prijedlog novog teksta, ispravke ili revizije grupe prosljeđuju Komisiji Ph. Eur. na usvajanje glasovanjem. Također možete, nakon što vas nominira naše nacionalno farmakopejsko tijelo, sudjelovati u radu neke od tih grupa. O radu u stručnim i radnim grupama možete pročitati na stranici HALMED-a ili EDQM-a. Popis svih stručnih i radnih grupa EDQM-a možete naći na stranici. Tajništvo nacionalnog farmakopejskog tijela možete kontaktirati na adresu UredZaFarmakopeju@halmed.hr.
- U cilju uspostavljanja uske suradnje između nacionalnog farmakopejskog tijela RH (NPA) s korisnicima farmakopeje u Hrvatskoj, drugim NPA-ima te Komisijom Europske farmakopeje (Komisija Ph. Eur.), njezinim stručnim grupama i radnim tijelima, u HALMED-u je osnovano Povjerenstvo za farmakopeju Agencije za lijekove i medicinske proizvode (Povjerenstvo HRF-a), koje je 15. listopada 2014. godine održalo svoju prvu sjednicu. Stalni sastav Povjerenstva, uz imenovane predstavnike Ureda za farmakopeju pri HALMED-u, čine predstavnici najraširenijih područja djelovanja farmacije u Republici Hrvatskoj, preko kojih možete uputiti svoja pitanja, komentare i prijedloge nacionalnom farmakopejskom tijelu ili Komisiji Europske farmakopeje. Više o radu Povjerenstva za farmakopeju možete pročitati na stranici. Na stranici možete naći raspored sjednica Povjerenstva i zapisnike s dosadašnjih sastanaka. Povjerenstvo možete kontaktirati na adresu UredZaFarmakopeju@halmed.hr.
- Europsko ravnateljstvo za kakvoću lijekova i zdravstvenu skrb (European Directorate for the Quality of Medicines & HealthCare - EDQM) objavljuje online časopis Pharmeuropa u kojem možete naći prijedloge novih i revizija tekstova Europske farmakopeje za javnu raspravu. Tekstovi su dostupni tri mjeseca i mogu se davati komentari, prijedlozi za ispravke i sl. Tek nakon što se svi dobiveni komentari objave, tekst će biti ponovno tiskan za raspravu preko Pharmeurope ili predan komisiji Europske farmakopeje na prihvaćanje. Preporučuje se da svoje komentare tekstova poduprete argumentima i šaljete ih EDQM-u preko nacionalnog farmakopejskog tijela, koje dalje o njemu vodi brigu do prihvaćanja ili odbijanja i o tome vas obavještava. Adresa nacionalnog farmakopejskog tijela je UredZaFarmakopeju@halmed.hr. Svoje zahtjeve za izradu novog teksta u Europskoj farmakopeji ili reviziju postojećeg možete poslati nacionalnom farmakopejskom tijelu. Upute o postupku možete naći na stranici. Adresa nacionalnog farmakopejskog tijela je UredZaFarmakopeju@halmed.hr.